
Fundamentos
Señales de excitación de voltaje frente a tiempo
Celda para voltamperotrías
Electrodos indicadores o de trabajo
Voltamperogramas
Voltamperogramas de mezclas
Amperometría
Sensores amperométricos
Instrumentación
Aplicaciones de voltametría y amperometría
1
CONTENIDOS
1

1. Fundamentos
Se llaman métodos voltamétricos o voltamperométricos a las técnicas electroanalíticas que se basan en la medida de la corriente en una celda electroquímica en función del potencial aplicado a un electrodo pequeño.
La polarografía es la voltametría con el electrodo de gotas de mercurio (EGM)
El campo de la voltametría se desarrolló a partir de la polarografía, que descubrió el químico checoslovaco Jaroslav Heyrovsky a comienzos de la década de 1920, por lo que recibió el premio Nobel.
2
AnalitoOx + e- ? AnalitoRed
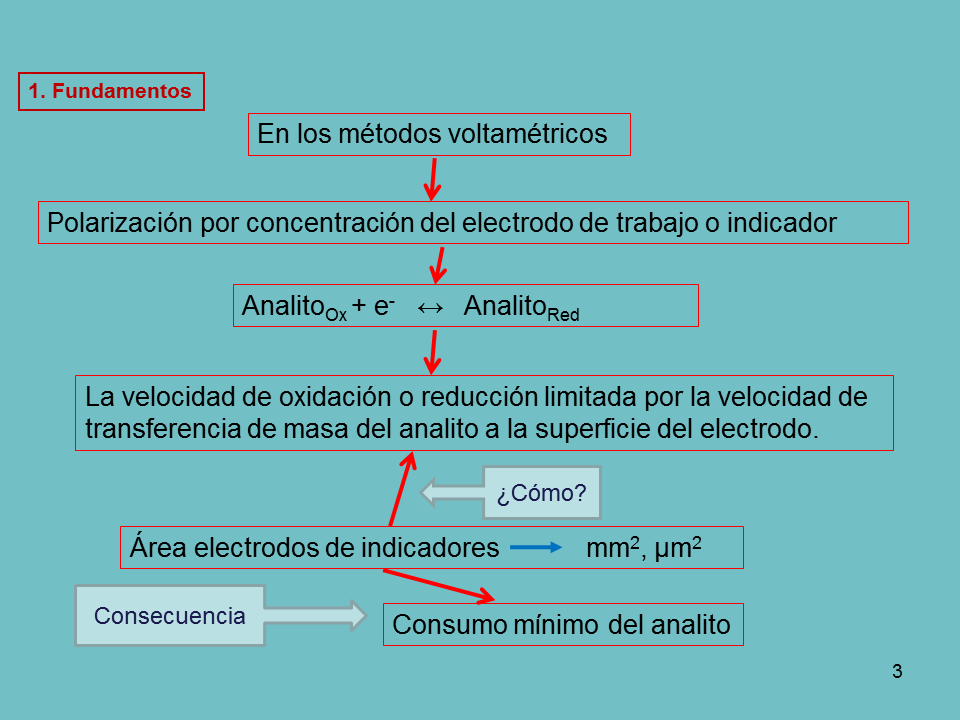
En los métodos voltamétricos
Polarización por concentración del electrodo de trabajo o indicador
La velocidad de oxidación o reducción limitada por la velocidad de transferencia de masa del analito a la superficie del electrodo.
Área electrodos de indicadores mm2, µm2
Consumo mínimo del analito
1. Fundamentos
¿Cómo?
Consecuencia
3

En voltametría, el voltaje del electrodo de trabajo se varía de manera sistemática mientras se mide la respuesta de la corriente.
Se pueden aplicar al electrodo varias funciones distintas de voltaje-tiempo llamadas señales de excitación.
La más sencilla es un barrido lineal, en el que el potencial del electrodo de trabajo se varía linealmente con el tiempo.
Las voltametrías se clasifican según el tipo de función voltaje – tiempo aplicado.
En este tema nos centraremos en la voltametría hidrodinámica o de barrido lineal, en la que el potencial del electrodo indicador o de trabajo se varía linealmente con el tiempo y se mide la intensidad de corriente producida.
2. Señales de excitación voltaje frente a tiempo
4

5
2. Señales de excitación voltaje frente a tiempo
Señales de excitación voltaje – tiempo mas usados en voltametría
Fig 1

6
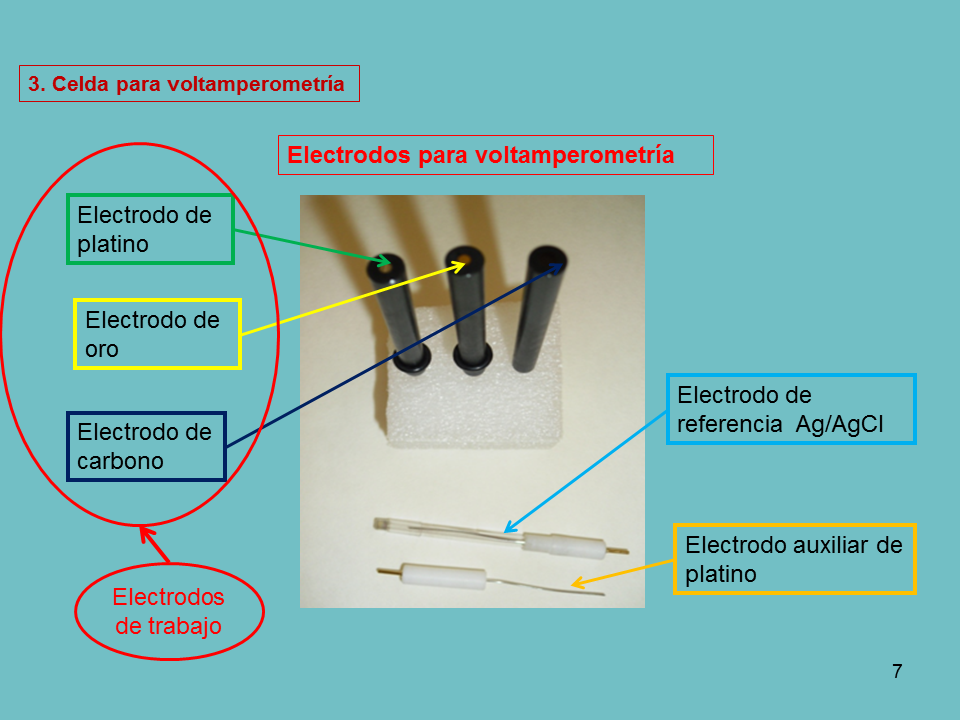
La celda consta de 3 electrodos:
Electrodo indicador o de trabajo, de dimensiones pequeñas para intensificar su tendencia a la polarización.
Electrodo de referencia, que tiene un potencial que permanece constante durante el experimento.
Electrodo auxiliar o contraelectrodo que suele un alambre de platino.
3. Celda para voltamperometría
7
Electrodos para voltamperometría
Electrodo de platino
Electrodo de oro
Electrodo de carbono
Electrodo de referencia Ag/AgCl
Electrodo auxiliar de platino
Electrodos de trabajo
3. Celda para voltamperometría

8
3. Celda para voltamperometría
El potencial E se aplica entre el electrodo de trabajo y el electrodo de referencia y se varía linealmente con el tiempo.
La corriente de la celda i pasa entre el electrodo de trabajo y el contraelectrodo
La fuente de la señal es una fuente de alimentación de corriente continua variable.
El voltamograma se obtiene al registrar la intensidad de la corriente resultante (i) en función del potencial (E) entre los electrodos de trabajo y de referencia

4. Electrodos indicadores o de trabajo
Los electrodos de trabajo tienen formas diversas. Por lo general, se trata de pequeños discos planos de un conductor, que se introducen a presión en una varilla de material inerte, como el Teflón, que lleva incorporado un contacto de alambre.
El conductor puede ser un material inerte, como el platino u oro; grafito o carbono vitrificado.
En polarografía se utiliza el electrodo de gotas de mercurio
9
Pt
Au
C
Fig 1

10
El intervalo de potenciales aplicable a estos electrodos en disoluciones acuosas es variable y depende:
del material del electrodo,
de la composición de la disolución en la que se sumerge.
El límite de potenciales positivos es el de la oxidación del agua para dar oxígeno molecular.
El límite negativo es el de la reducción del agua, para dar hidrógeno.
Los electrodos de mercurio toleran potenciales negativos relativamente grandes, debido al alto sobrevoltaje del hidrógeno en este metal.
4. Electrodos indicadores o de trabajo
Limitaciones de uso de los electrodos en medio acuoso

11
4. Electrodos indicadores o de trabajo
Limitaciones de uso de los electrodos en medio acuoso
OXIDACIÓN
REDUCCIÓN
Reducción del hidrógeno
2 H+ + 2 e- ? H2
-3 V
0 V
+3 V
Oxidación del agua
2 H2O ? 4 H+ + O2 + 4 e-

5. Voltamperogramas
Voltamperograma de barrido lineal característico para la reducción de una especie A (analito) para obtener un producto P.
La corriente límite il o id es proporcional a la concentración del analito y se usa para análisis cuantitativo.
il = k cA
El potencial de onda media E1/2 es el potencial aplicado que produce una i = id/2. Se relaciona con el potencial estándar de la semirreacción y se utiliza para la identificación cualitativa de la especie.
El voltamperograma es la representación de la intensidad de corriente obtenida en función del potencial aplicado al electrodo de trabajo
Las corrientes catódicas (de reducción) son positivas, y las anódicas, negativas.
Los potenciales menos positivos (más negativos) van de izquierda a derecha.
12

13
5. Voltamperogramas
il = k cA
Análisis cuantitativo
Análisis cualitativo
E 1/2
Fig 1

6. Voltamperogramas de mezclas
Voltamperogramas de un par de mezclas A y B de dos componentes.
Los potenciales de onda media de los dos componentes de la curva A difieren en 0,1 V y los de la curva B en 0,2 V
Un solo voltamperograma permite la determinación cuantitativa de dos o más especies, siempre y cuando exista una diferencia suficiente entre los potenciales de onda media para posibilitar la evaluación de las corrientes de difusión de cada especie.
En general, se requieren unas cuantas décimas de voltio de diferencia para resolver especies distintas.
Un voltamperograma de una mezcla es la suma de las ondas de sus componentes, debido a que las especies electroactivas de una mezcla se comportan con independencia una de otra en un electrodo voltamétrico
14
(Il )1
(Il )2
1
2
(E1/2)

15
Análisis cuantitativo mezclas
Análisis cualitativo mezclas
6. Voltamperogramas de mezclas

16
La amperometría se basa en la medida de la corriente límite a un potencial aplicado constante y apropiado para que se alcance la misma, y así relacionar la corriente medida con la concentración del analito.
il = k cA
Se trabaja con agitación, fijando E y midiendo iL
E cte seleccionado
7. Amperometría
En las determinaciones amperométricas la concentración de analito en la muestra se puede obtener:
a partir de la recta de calibrado con patrones de concentración conocida
por el método de adición estándar
Página siguiente  |