
(Gp:) E°celda= RT ln K
nF
En condiciones estandar T= 298°K y sustituyendo los valores de las constantes R y F
E°celda= (8.134 J/Kmol) (298°K) ln K
n(96500J/Vmol)
E°celda= 0.0257 V ln K
n
E°celda= 0.0592 V log K
n

ECUACIÓN DE NERST
El valor de la fem depende de las concentraciones de las soluciones, de la temperatura, y del potencial de cada especie que participa en el proceso REDOX
Para lograr un patrón se definió al Potencial Normal de Oxidación (Eo oxidación) como aquel medio en CNPT (1atm, 1M y 25°C) con respecto al cero, que en este caso lo tiene el electrodo de Hidrógeno.
Para calcular el potencial fuera de esas condiciones se utiliza la EC. De NERST
(Gp:) aA + bB cC + dD
?G = ? G° + RT lnQ
-nFE= -nFE° + RT lnQ
Dividiendo la ecuación entre –nF obtenemos
(Gp:) E= E° – RT lnQ
nF
Q es el cociente de la reacción.
ECUACIÓN DE NERST

Eeq = E? + (0.0592/n) * log [ox]x / [Red] y
(Gp:) E= E° – RT lnQ
nF
E= E° – 0.0257v lnQ
n
E= E° – 0.0592v log Q
n
En la celda galvanica, los e- fluyen del ánodo al cátodo, lo que da la formación de los productos y una disminución en la concentración de los reactivos, aumentando Q.
Sí Q? E?
En el equilibrio NO hay transferencia de e-, E=0 y Q=K, donde K es la cte de equilibrio.
(Gp:) Cu+2 (ac) + Zn (s) Cu (s) + Zn+2
(Gp:) E= 1.10V – 0.0592v log [Zn+2]
2 [Cu+2]
Sí el cociente [Zn+2]/[Cu+2] es menor a 1, el log será un # – y el 2do. Término se hace +. E será mayor que la fem estandar (E°).
Sí el cociente es mayor a 1, E será menor que E°
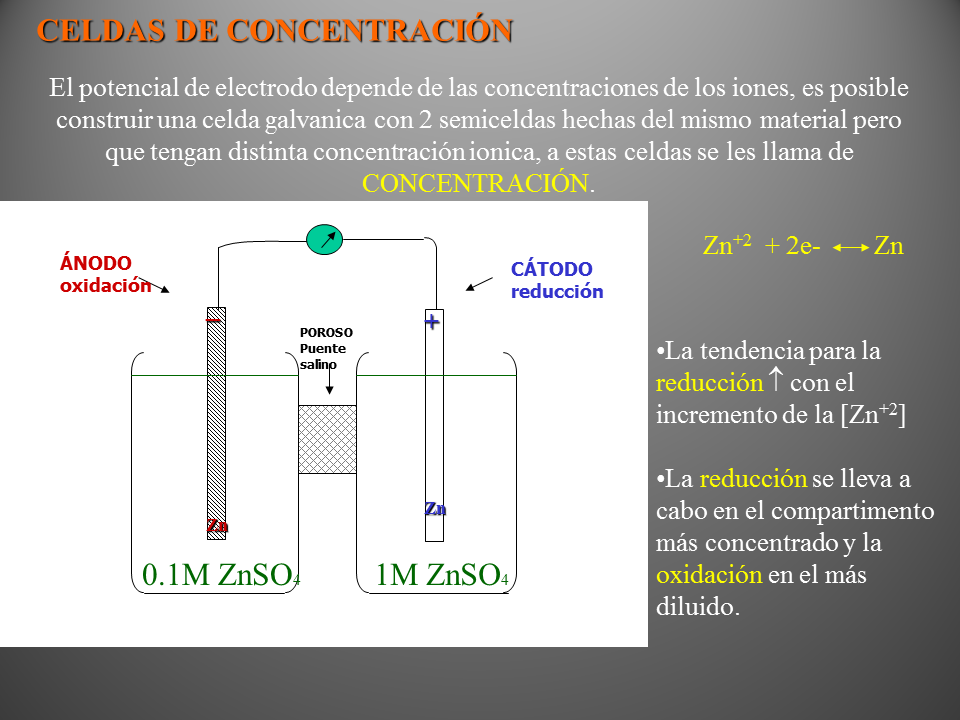
CELDAS DE CONCENTRACIÓN
El potencial de electrodo depende de las concentraciones de los iones, es posible construir una celda galvanica con 2 semiceldas hechas del mismo material pero que tengan distinta concentración ionica, a estas celdas se les llama de CONCENTRACIÓN.
(Gp:) POROSO
Puente salino
(Gp:) ÁNODO
oxidación
(Gp:) CÁTODO
reducción
(Gp:) 0.1M ZnSO4
(Gp:) 1M ZnSO4
(Gp:) _
Zn
(Gp:) +
Zn
(Gp:) Zn+2 + 2e- Zn
La tendencia para la reducción ? con el incremento de la [Zn+2]
La reducción se lleva a cabo en el compartimento más concentrado y la oxidación en el más diluido.

Zn(s)|Zn+2(0.1M)||Zn+2(1M)|Zn(s)
Semirxn’s
Oxidación: Zn(s) ? Zn+2(0.1M) + 2e-
Reducción: Zn+2(1M) + 2e- ? Zn(s)
RXN Global Zn+2 (1M) ? Zn+2(0.1M)
Fem de la celda
(Gp:) E= E° – 0.0257v ln [Zn+2]dil
2 [Zn+2]conc
(Gp:) E= 0V – 0.0257v ln 0.1
2 1
E= 0.0296V
La fem de las celdas de concentración suele ser pequeña y va ? continuamente durante la operación de la celda a medida que se igualan las concentraciones iónicas en los 2 compartimentos. Cuando son iguales se convierte en cero y ya no hay cambios

En teoría
Ecelda = Ecátodo – Eánodo
En realidad
Ecelda = Ecátodo – Eánodo (? Eunión líquida ? Ecaída óhmica ? Etranf. de masa. ? Etransf. de carga)
( ): Sobretensión
+: Corresponde a una celda electrolítica ? E (teórico) < E (real) ? Hay que suministrar más voltaje del esperado para producir la reacción redox
–: Corresponde a una celda galvánica ? E (teórico) > E (real) ? El voltaje de la pila es menor del esperado
Potencial de una celda electroquímica

Electrodos de referencia
Características principales
a) Insensible a cambios de concentración en la disolución
b) Fácil de preparar
c) Potencial de equilibrio debe alcanzarse rápidamente
d) No sujeto a fenómenos de polarización
Tipos
a) Electrodo normal de hidrógeno (apenas usado en la actualidad)
b) Electrodo de calomelanos (el más usual es el saturado)
c) Electrodo de Ag+/AgCl

Electrodo de calomelanos saturado
Montaje: Un hilo de Pt introducido en una disolución de Hg, Hg2Cl2 (calomelanos) y KCl (saturada)
Reacciones: Hg22+ + 2 e- ? 2 Hg0 Hg2Cl2(s) ? Hg22+ + 2Cl-
Ecuación de Nerst:
4.16 M
?
?
?

Electrodo de Ag/AgCl
Montaje: Un hilo de Ag introducido en una disolución de KCl en contacto con un precipitado de AgCl
Reacciones:
Ag+ + e- ? Ag0 ; AgCl(s) ? Ag+ + Cl-
Ecuación de Nerst:
?
?
?

Requisitos principales
1) Su potencial debe variar con la concentración de la especie electroactiva, de acuerdo con la Ley de Nerst
2) Respuesta rápida
3) Respuesta reproducible
4) Fácil de preparar
5) Forma física cómoda para el manejo
6) Resistente física y químicamente
7) Variación pequeña del potrencial con la temperatura
1) Electrodos metálicos
2) Electrodos de membrana: Electrodos selectivos de iones
Tipos
Electrodos indicadores

Montaje: Un hilo de metal introducido en una disolución de una sal poco soluble (o complejo poco disociado) del ion metálico. Ej.: Ag en AgCl
Respuesta: A la actividad del anion
Ecuación de Nerst:
De 2ª Especie
De 1ª Especie
Electrodos metálicos
Montaje: Un hilo de metal introducido en una disolución con sus iones. Ej.: Cu en disolución de Cu2+
Respuesta: A la actividad del propio ion metálico
Ecuación de Nerst:
(Gp:) ?
?
?
?

Montaje: Un hilo de metal introducido en una disolución que contiene las formas oxidadas y reducidas de otro metal. Ej.: Pt en Fe2+ y Fe3+
Respuesta: A la relación de actividades de las forma oxidada y la reducida
Ecuación de Nerst:
Inerte
De 3ª Especie
Electrodos metálicos
Montaje: Un hilo de metal introducido en una disolución de dos sales insolubles de un mismo anion. Los cationes son: 1) La forma oxidada del metal; 2) El que queremos determinar. Ej.: Ag en Ag2C2O4 y CaC2O4
Respuesta: A la actividad del un ion metálico para el que no se pueda fabricar uno de 1ª especie
Ecuación de Nerst:
?

– Desarrollados para la determinación de especies que no disponen de un electrodo de 1ª o 2ª especie adecuado (el de 3ª especie es muy difícil de montar)
– Definición IUPAC: Sensores electroquímicos que responden de manera lineal al logaritmo de la actividad de un ion dado en disolución
– No basado en reacción redox (como los anteriores) ? Ley de Nerst modificada
– El ?E responde a un cambio de energía libre asociado a un proceso de transferencia de masa a través de una membrana ? Electrodos de membrana
– Montaje general:
Introducción
Electrodos selectivos de iones
(Gp:) Electrodo
(Gp:) Muestra
(Gp:) Disolución 1, (aM)1
(Gp:) Disolución 2, (aM)2
(Gp:) Membrana
(Gp:) ?E

1) Selectividad ? Responden de manera selectiva pero no específica ? KA,B (Coeficiente de selectividad)
2) Límite de respuesta o de detección) ? Concentración para la cual no existe linealidad al representar E vs log aA
3) Rango de respuesta o de linealidad ? Entre 4 y 8 órdenes de magnitud (2 o 3 en técnicas ópticas)
4) Tiempo de respuesta ? Desde que se introduce el electrodo hasta que la señal es estable (señal ? 1 mV)
Depende de:
– Tipo de electrodo – Temperatura
– Nivel de concentración – Concentración de otros iones
– Agitación
(Gp:) ?
(Gp:) No es E0
(Gp:) carga del ion
Características del electrodo de membrana

1) Electrodo de vidrio
– La diferencia de potencial se genera a través de una membrana de vidrio (no cualquiera) que es sensible a cambios de pH
2) Electrodo de membrana líquida
– La membrana es un líquido con propiedades de intercambiador de iones
3) Electrodo de membrana precipitada o sólida
– La membrana es una sal insoluble del anion que se quiere determinar
4) Electrodo sensible a gases
– Celda sensible a gases disueltos en disolución
Tipos de electrodos de membrana

Fundamento: La diferencia de potencial se genera a través de una membrana de vidrio que es sensible a cambios de pH ? Vidrio Corning 0.15 (72% SiO2, 22% Na2O y 6% CaO)
Características:
– La membrana tiene que estar hidratada (50 mg H2O/cm3 de vidrio) ? Medidas erróneas en dvtes no acuosos
Electrodo de vidrio
Electrodo
Muestra
E
Capa
hidratada
Capa
hidratada
Capa
anhidra
Na+
H+ Na+
Na+ H+
(HCl=0.1N)

– Usos: Diseñados para la determinación de cationes polivalentes y ciertos aniones
– Fundamento: Se basa en utilizar una membrana líquida (inmiscible con el H2O y situada entre soportes sólidos porosos) que es un intercambiador de cationes
– Reacción de intercambio:
Electrodos de membrana líquida
Electrodo
Muestra
E
Reacción influenciada por el pH ? medidas erróneas a pH<5.5

Electrodos de membrana precipitada o sólida
– Usos: Diseñados para la determinación de aniones
– Fundamento: Se basa en utilizar una membrana sólida (contiene el anion a determinar). Ej.: LaF3 para determinar F-)
– Reacción (que determina la ?E):
– Inconvenientes:
– Menor consistencia que el vidrio ? La membrana se deteriora con facilidad (¡Ojo!, con el pH de trabajo ? se puede disolver)
– Menor conductividad que el vidrio ? El tiempo de respuesta es más largo

Electrodos sensibles a gases
– Usos: Diseñados para la determinación de gases disueltos
– Montaje: Electrodo indicador (normalmente de vidrio) y de referencia (normalmente calomelanos) alojados en un tubo que se aísla del exterior por una membrana permeable a gases ? No es un electrodo (la membrana no interacciona), es una celda sensible a gases
– Fundamento: El gas disuelto atraviesa la membrana (no interacciona) y modifica el potencial del electrodo indicador. Ej.: Determinación de CO2
– Reacción (que determina la ?E):
Se modifica el pH

CORROSIÓN
Es el término que suele aplicarse al deterioro de los metales por 1 proceso electroquímico.
Ejemplos: hierro oxidado, plata empañada, el color verde que se forma sobre el Cu y el laton.
Fe(s) ? Fe+2 + 2e-
Los e- donados por el Fe reducen el oxígeno atmosférico a agua en el cátodo, que a su vez es otra región de la misma superficie del metal
O2 (g) + 4H+ (ac) + 4e- ? 2H2O(l)
RXN Global 2Fe(s) + O2(g) + H+(ac) ? 2Fe+2 + 2H2O(l)
Fem E°celda= E°cátodo – E°ánodo= 1.23V – (-0.44V) = 1.67V
Protección catódica
http://www.youtube.com/watch?v=QYd9ENn1nP0&feature=related

DISPOSITIVOS ELECTROQUÍMICOS
Baterías
Supercapacitores
Celdas de Combustible
Celdas Fotoelectroquímicas
Dispositivos Electrocrómicos
ALMACENAMIENTO DE ENERGÍA
CONVERSIÓN
DE ENERGÍA
Factor común “QUIMICA REDOX”
Electrones, iones, electrodos, valencia mixta, electrolito

Dispositivos de Almacenamiento de Energía
Capacitores
(Gp:) Supercondensadores
(Gp:) Electroquímicos
(Gp:) Baterías
Celdas de
Combustible
(Gp:) menor mayor
(Gp:) Energía Almacenada
(Gp:) Potencia
(Gp:) +
Capacitores
(Gp:) Supercondensadores
(Gp:) Electroquímicos
Baterías
Supercondensadores
Electroquímicos
Supercondensadores
Electroquímicos
Baterías
Celdas de
Combustible
menor mayor
Energía Almacenada
Potencia
+
Potencia
+

Que es una BATERIA?
Es un dispositivo que permite que la energía liberada de una reacción química sea convertida directamente a electricidad
Electricidad portátil (relojes, celulares, aparatos electrónicos, etc)
Almacenamiento de Energía por una fuente Externa (vehiculos eléctricos, energías renovables
(Gp:) Breve Historia del desarrollo de las baterías
(Gp:) 1ra. Batería por Alessandro Volta en 1800
1745-1847
Ahora las baterías son indispensables y se pueden encontrar en gran variedad de aplicaciones
(Gp:) 1830 La introducción del telégrafo eléctrico dio lugar al desarrollo de baterías comercialmente viables.
(Gp:) 1900 Con la invención de la lámpara incandescente se les dio un uso práctico y comercial.
(Gp:) 1840 Primera Batería que daba una alta corriente
(Gp:) 1920 mayor difusión con el desarrollo de radios domésticos,
(Gp:) Ampère, Arrhenius, Bacon, Becquerel, Cruikshank, Daniell, Davy, Edison, Faraday, Jungner, Leclanché, Nerst, Oersted, Planté, Rutherford, y Volta

Baterias
Una batería consiste en una o más celdas electroquímicas conectadas en serie o en paralelo para dar los requerimientos deseados de potencial o corriente.
Se necesita un OXIDANTE y REDUCTOR muy fuerte, y la Eo tiene que ser lo + grande posible para que sea buena
Anodo: electrodo electropositivo donde los e- se generan
Catodo: electrodo electronegativo donde los e- se aceptan
Electrolito : Permite el transporte de los iones
Colectores de Corriente : permite el transporte de los e- entre los electrodos.
Separador : permite aislar electronicamente al ánodo y al cátodo (es permeable a los iones)

200 aC
« Invention » de la batterie Alessandro Volta 1800

(Gp:) separador
(Gp:) Electrodo negativo
(ánodo)
(Gp:) Electrodo positivo
(cátodo)
(Gp:) carga
(Gp:) electrolito
Diseño de Baterías
Aspectos Termodinámicos
RXN espontánea. E grande
Productos estables
Aspectos Cinéticos
RXN rápida
Potencia (cuantos e-/min)
Efectos de transporte de masa
Minimización del tamaño
Diseño de electrodos (microestructura)
Eliminación de productos?
La batería de Li termodinámicamente es buena pero cinéticamente hay problemas

BATERIAS
PRIMARIAS
SECUNDARIAS
(VOLTA, DANIELL…)
Zn/sal/Ag, Zn/ZnSO4//CuSO4/Cu
gran densidad energética
alto voltaje ya que solo hay una descarga
El precio es importantisimo
(RECARGABLES) empiezas cargandolas
Lead-acid(1860), Edison Cell (1900), Ni-Cd cell, Zn-Cl (1970), Lii (1980)
Buena ciclabilidad
El precio no es tan importante

Celda de Daniell (1836)
Electrodo Negativo se oxida
Zn0 + SO4- ? Zn(II) SO4 + 2e-
Electrodo Positivo se reduce
Cu(II)SO4 + 2e- ? Cu0 + SO4

Baterias Primarias ó Irreversibles ó Galvánicas
No están diseñadas para ser recargadas y son productos que generalmente tienen alta energía por unidad de volumen (densidad de energía), además tienden a diseñarse de forma que no se descarguen significativamente cuando se almacenan.
(Gp:) Leclanché (1860) diseñada con menor cantidad de electrolito utilizando (NH4Cl+ZnCl2) MnO2 como electrodo positivo y Zn como electrodo negativo.
De esta celda se derivó el sistema portátil sellado zinc-dióxido de manganeso.
(Gp:) Leclanché
(Gp:) Terminal Positiva
(Gp:) Vara de Carbono
(Gp:) separador
(Gp:) Contenedor de Zn
(Gp:) Terminal Negativa
(Gp:) Electrolito
(Gp:) MnO2
Cátodo MnO2 + e- MnOOH + (NH3, 2OH-) según electrolito
Ánodo Zn (polvo) – 2e- Z+2 (ZnO, Zn(NH3)Cl2) según electrolito

(Gp:) Baterías alcalinas de manganeso
(1861, Lalande y Chaperon )
Comercialización 1960s
Es 1 variación de la celda básica de Leclanché (Zn/KOH/carbono-MnO2).
Mejores prestaciones (mayor potencia).
Baterías de Botón
Después de la II Guerra Mundial (interesados en la miniaturización para audífonos.
Zn0 + Ag2O ? 2Ag + ZnO 1.589V
b) Alcalina Zn-Aire
Zn0 +1/2 O2 ? ZnO 1.645V

1973 SAFT 1ra. Bateria de Li primaria comercial
Operación a un rango amplio de temperaturas
Mayor densidad energética
Voltaje
2.8V
Días
2500
Voltaje alto = 3V, Descarga plana
Voltaje
2.8V
Durabilidad (h)
1000
Inicial
Despues de 10
Años a Tamb.
Vida larga sin usar

Se desarrollaron despues de la II guerra mundial
Interés en la miniaturización para audifonos

Baterias Secundarias o acumuladores
Están diseñadas para que sean eléctricamente recargables son sistemas electroquímicos
Reversibles.
En la descarga aportan energía (celdas galvánicas) y en la recarga se comportan como celdas
electrolíticas.
La batería está compuesta por 2 electrodos (cátodo y ánodo) separados por un electrolito
conductor iónico.
Debido a que en las baterías recargables la polaridad de los electrodos cambia según el proceso; ya sea de carga o de descarga, la terminología utilizada para denominar a los electrodos es: Cátodo al electrodo positivo y ánodo al electrodo negativo; siempre considerando el sistema en proceso de descarga.
(Gp:) separador
(Gp:) Electrodo negativo
(ánodo)
(Gp:) Electrodo positivo
(cátodo)
(Gp:) carga
(Gp:) electrolito
Sistemas comerciales:
Pb ácido
Alcalinas
Ni-Cd
Ni- HM
Li

Condiciones requeridas:
? Potencial másico elevado
? Densidad energética elevada
? buena ciclabilidad
? long shelf life
? Estabilidad Térmica
? Toxicidad baja
? Seguridad
75 accidentes en avions entre 1991 et 2007
De 110 milliones de baterias posibles, solamente 30 son comerciales. Porque?

Características que definen a las baterias:
? Rendimiento Faradaico (carga específica): Cantidad de carga Q = I*t 1 C/s = 1 A (1 mAh=3.6 C)
Por unidad de masa: mAh/g
? Potencia: Energía por unidad de tiempo P = E x I (W = V x A)
? Energía: Watthora (Wh) = E (v) x Q (Ah) 1Wh=3600 J
? Energia masíca o volumétrica (Energía Específica, Densidad Energética) (Wh/kg Wh/l)
? Potencia másica o volumetrica (Power density) (W/kg W/l)
? Ciclabilidad o tiempo de vida: eficiencia coulombica minima del 80%
Diagrama de Ragone
MRS Bull., 33, 411, 2008
Chemical Reviews, 2004, Vol. 104, No. 10 4247

Pb – ácido
1860 con Planté, y comercialmente en 1881 por Fauré
En 1900s el electrolito liquido se inmobilizó en fibras y la bateria se tapo
Ventajas: bajo costo y buena reversibilidad
Aplicación: automoviles, aplicaciones estacionarias 50% ventas
(Gp:) separador
(Gp:) carga
(Gp:) H2SO4
(Gp:) Pb
(Gp:) PbO2
(Gp:) Electrodo Negativo se oxida
(Gp:) Pb + H+ + HSO4- PbSO4 + 2H+ + 2e-
(Gp:) Electrodo Positivo se reduce
(Gp:) Pb(IV)O2 + 3H+ + HSO4- + 2e- Pb(II)SO4 + 2H2O
(Gp:) La reacción involucra al electrolito

Pb + HSO4- ? PbSO4 + H+ + 2e-
PbO2 + 3H+ + HSO4- + 2e- ? PbSO4 + 2 H2O
——————————————————–
Pb + Pb2O + 2 H2SO4 ? 2 PbSO4 + 2 H2O
Bateria Pb-PbO2
Es contaminante
Dan gran potencia
Densidad de energía pequeña

Alcalinas
(Gp:) Ni-Cd
(Gp:) 1899 1ra patente en Suecia de Jungner
1933 Dassler 1er paso al desarrollo de la batería sellada
Ventajas: vida larga, bajo mantenimiento, puede operar a T bajas
Desventajas: mas caras que Pb-ácido, el Cd no es ecológicamente amigable
Aplicación: encendido de autos, luces de seguridad, apararos inalámbricas, industria aeroespacial. Ventas 7%
Efecto Memoria: pérdida de carga debido a un cambio de fase en el catodo debido a una sobrecarga que implica reacción con el electrolito.

(Gp:) separador
(Gp:) carga
(Gp:) KOH (Aq)
(Gp:) Cd
(Gp:) Ni(OH)3
(Gp:) Electrodo Negativo se oxida
(Gp:) Cd + 2OH- Cd(OH)2 + 2e-
(Gp:) Electrodo Positivo se reduce
(Gp:) 2Ni(OH)3 + 2e- 2Ni(OH)2 + 2H
La reacción NO involucra al electrolito, solo juega el papel de transportados de iones
No es sencilla la
RXN xq hay fases
Ni-MH
Mismo Cátodo
Ni-H2
Para Satelites porque funcionan a T muy bajas
Para coches eléctricos

Baterías recargables de Li
Las baterías Ni-Cd y Pb-ácido presentan bajas densidades de energía (30-70Wh/Kg, 50-150Wh/Kg) y debido a necesidades del mercado se requería del desarrollo de al menos con el doble.
(Gp:) Antecedentes
(Gp:) 1950s se descubre que el Li era estable en electrolitos NO-acuosos
1960s comercialización de baterías Primarias para aplicaciones militares, relojes, calculadoras, implantación de dispositivos médicos
1970s Se encontraron varios compuestos inorgánicos que reaccionaban con metalies alcalinos de manera reversible.
Auge en los 70s debido a la crisis petrolera y hubo la necesidad de diseñar baterías con mayor densidad energética que las obtenidas hasta entonces .
1973 1ra. Batería recargable de Li con cátodos de especies inorgánicas laminares
1990 El proceso recargable de las baterías con anodos de Li presentó problemas debido a la formación de dendritas, los cuales fueron resueltos insertando el Li en grafito dando una mayor vida.
1991 Sony comercializó la 1ra. Batería recargable de ion Li con un ánodo de carbón y un cátodo de LiCoO2 teniendo un voltaje de 3.6V(3 veces mayor que las alcalinas.
1999 Bellcore introdujo el electrolito polimérico dando lugar a la batería PLiON que es delgada, y dio lugar a la miniaturización de los aparatos electrónicos.

Este metal alcalino es el más ligero y más electropositivo de toda la familia de metales aportando 1e- por 6.97g
el plomo 2e- por 205g
el cadmio 2e- por 112g
(Gp:) 3860 Ah/Kg.

(Gp:) Ánodo de LixC6
(Gp:) Ánodo de Litio metálico
¿Cómo funciona una batería recargable de Li?
(Gp:) Ánodo
Li metálico
(Gp:) Cátodo
(Gp:) e-
(Gp:) e-
(Gp:) Li+
Descarga
(Gp:) Carga
Li+
(Gp:) e-
(Gp:) e-
(Gp:) Ánodo
Li metálico
(Gp:) Carga
Li+
(Gp:) e-
(Gp:) e-
(Gp:) Cátodo
Cátodo
Ánodo
LixC6
(Gp:) e-
(Gp:) e-
(Gp:) Carga
Li+
(Gp:) Li+
Descarga
(Gp:) e-
(Gp:) e-
(Gp:) Cátodo
(Gp:) Ánodo
LixC6

Batería recargable de Li Comercial
(Gp:) Li+
Descargada
(Gp:) e-
(Gp:) e-
(Gp:) LiCoO2
(Gp:) Ánodo
LixC6
Debido a que el Co es el componente mas caro de toda la batería y es tóxico, la INVESTIGACIÓN se ha centrado en el desarrollo de materiales nuevos para el CÁTODO.
LiNiO2 : es más barato, es mas reversible,
Existen reacciones exotérmicas con el electrolito
que hace la batería muy insegura.
Su síntesis es dificil a gran escála.
LiMn2O4 : tiene diferente estructura que los 2 anteriores. Es más barato y mas ecológico.
Su ciclabilidad es mala.
LiNi1/2Mn1/2O2 : Es barato y su ciclabilidad se ve mejorada.
Fosfatos de metales de transición : parecen tener mucho futuro que dan mayores voltajes, pero tienen mala conductividad electrónica.

CELDA DE COMBUSTIBLE
Dispositivo electroquímico que convierte la energía de una reacción química directamente en electricidad .

4. De Polímeros (PEM)
Electrodos de Pt/C
Electrolito Nafion (polímero con ac. Sulfonico fluorados)
Temperatura de funcionamiento 50-100°C, desarrollada para aplicaciones de transporte, aparatos portátiles.
Alta Eficiencia y potencia, vida larga
desventaja: la membrana es cara e inestable al calor, pierde conductividad
ANODO
2H2 4H+ + 4e-
CATODO
O2 + 4H+ 4e- 2H2O

5. De Metanol Directo (DMFC)
Electrodos de Pt/C
Electrolito Nafion (polímero con ac. Sulfonico fluorados)
Ventaja principal: la fácil transportación del MeOH y se está desarrollando para aplicaciones portátiles donde la desidad energética y de potencia es más importante que su baja eficiencia.
ANODO
CH3OH + H2O CO2 + 6H+ + 6e-
CATODO
3/2 O2 + 6H+ + 6e- 3H2O
CH3OH + 3/2 02 CO2 + 2H2O

CELDA SOLAR FOTOELECTROQUÍMICA
Celdas Grätzel (3ra. Generación)
No hay unión entre semiconductores
TiO2 absorbe en el UV y se añade 1 pigmento que absorba en el VIS con un V adecuado p/q los e- fluyan al TiO2
El TiO2 debe ser muy poroso para mejorar el contacto con el electrolito y tener el pigmento nanopartículoado
Uno de los problemas es que el electrolito es LÍQUIDO

Materiales Electrocrómicos
Cambian sus propiedades ópticas de forma reversible cuando se les aplica un V.
Inorgánicos (óxidos): Ti, Mo, Ta, W (coloración catódica) V, Cr, Mn, Fe, Co, Ni, Rh, Ir (coloración anódica)
Orgánicos (Polímeros Conductores)
Aplicación: displays, filtros de luz, ventanas inteligentes,
WO3 Rey de los materiales electrocrómicos
 Página anterior Página anterior |   Volver al principio del trabajo Volver al principio del trabajo | Página siguiente  |