
Visualización de una reacción química
Na + Cl2 NaCl
Cl del topo del _2
NaCl del topo del _
Na del topo del _
2
10
5
10
2
10
5

Formación de amoníaco
2 átomos N
6 átomos H
6 átomos H
2 átomos N y
+
+
+
+
+
+
+
+
+
1 molécula N2
3 moléculas H2
2 moléculas NH3
10 molécula N2
30 moléculas H2
20 moléculas NH3
1 mol de N2
3 mol de H2
2 mol de NH3
28 g N2
3 x 2 g H2
2 x 17 g NH3
34 reactivo de g
34 productos de g
N2 (G)
3 H2 (G)
2 NH3 (G)
22.4 L N2
67.2 L H2
44.8 L NH3
22.4
L
22.4
L
22.4
L
22.4
L
22.4
L
22.4
L
Asumir
STP
1 x
3 x
2 x
6.02 x 1023
moléculas N2
6.02 x 1023
moléculas H2
6.02 x 1023
moléculas NH3

Relaciones proporcionales
Tengo 5 huevos. ¿Cuántas galletas puedo hacer?
3/4 azúcar marrón de la C.
1 extracto de vainilla del tsp
2 huevos
2 virutas de chocolate de la C.
Hace las galletas 5 docenas.
2 1/4 harina de la C.
1 tsp. bicarbonato de sosa
1 tsp. sal
1 mantequilla de la C.
3/4 azúcar de la C.
5 huevos
2 huevos
= galletas 12.5 docenas
(Gp:) Cociente de huevos a las galletas
150 galletas
5 docenas
Conversión
Factor

Relaciones proporcionales
Estequiometría
relaciones totales entre las sustancias en un producto químico reacción
de acuerdo con el cociente de topo
Cociente de topo
indicado por coeficientes en una ecuación equilibrada
2 magnesio + O2 MgO del ? 2

Pasos de la estequiometría
1. Escribir una ecuación equilibrada.
2. Identificar sabido y desconocido.
3. Alinearse los factores de conversión.
Cociente de topo – topos del ??????? topos
Masa molar – gramos del ??????? topos
Molarity – litros soln del ??????? topos
Volumen molar – gas de los litros del ??????? topos
¡Paso de la base en todos los problemas de la estequiometría!!
Cociente de topo – topos del ??????? topos
4. Comprobar la respuesta.

1 mol de un gas=22.4 L
en STP
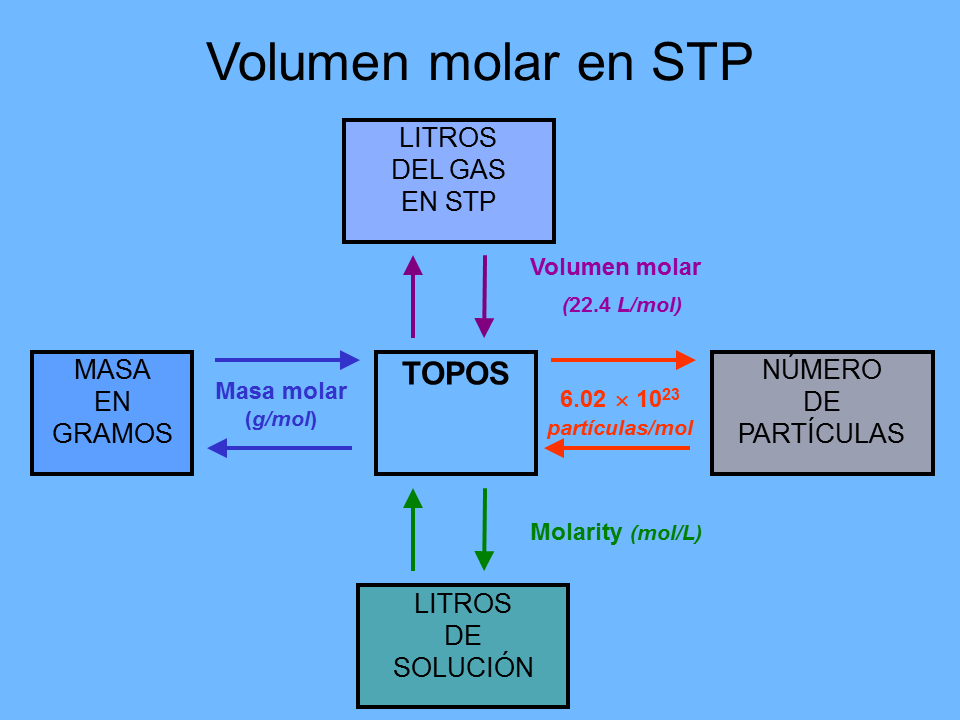
Volumen molar en STP
(Gp:) Temperatura estándar y presión
0°C y 1 atmósfera
(Gp:)
Volumen molar en STP
Masa molar
(g/mol)
6.02 ? 1023
partículas/mol
MASA
EN
GRAMOS
TOPOS
NÚMERO
DE
PARTÍCULAS
LITROS
DE
SOLUCIÓN
Volumen molar
(22.4 L/mol)
LITROS
DEL GAS
EN STP
Molarity (mol/L)

Problemas de la estequiometría
Cuántos topos de KClO3 debe descomponerse ¿para producir 9 topos de oxígeno-gas?
9 mol de O2
2 mol de KClO3
3 mol de O2
= 6 mol de KClO3
2KClO3 ? 2KCl + 3O2
¿? mol
9 mol

1. Sb 2 + Cl 32 ? 2 SbCl3
2. 2 magnesio + O2 MgO del ? 2
3. CaCl2 ? Ca + Cl2
4. 2 NaClO3 ? 2 NaCl + 3 O2
5. FE + 2 ? FeCl del ácido clorhídrico2 + H2
6. CuO + H2 Cu del ? + H2O
7. Al 2 + 3 H2TAN4 Al del ?2(TAN4)3 + 3 H2

7.5 mol
1. Sb 2 + Cl 32 ? 2 SbCl3
¿Cuántos topos del gas de la clorina se requieren reaccionar con 5 topos de antimonio?
5 mol
x mol
mol de Cl x2 = 5 mol de Sb
2 mol de Sb
3 mol de Cl2
=
7.5 mol de Cl2
Cuántos topos de SbCl3 se producen a partir de 5 topos de antimonio y de Cl del exceso2¿?
mol de x SbCl3 = 5 mol de Sb
2 mol de Sb
2 mol de SbCl3
=
5 mol de SbCl3
exceso
x mol
Cuántos topos de SbCl3 se producen a partir de 7.5 topos de Cl2 ¿y exceso de Sb?
mol de x SbCl3 = 7.5 mol de Cl2
3 mol de Cl2
2 mol de SbCl3
=
5 mol de SbCl3
2
5 mol
3
x mol
(Gp:) =
2 x = 15
x = 7. 5 mol
exceso

2. 2 magnesio + O2 MgO del ? 2
¿Cuántos topos del óxido de magnesio se producen del burning de 10 mol de magnesio?
x mol MgO = 10 mol de magnesio
2 mol de magnesio
2 mol de MgO
=
10 mol de MgO
x mol
10 mol
¿Cuántos litros de oxígeno son necesarios quemar 10 mol de magnesio?
x L O2 = 10 mol de magnesio
2 mol de magnesio
1 mol de O2
=
5 mol de O2
Asumir 1 mol de O2 = 22.4 L
1 mol de O2
22.4 L O2
=
112 L O2
x L
x L O2 = 10 mol de magnesio
2 mol de magnesio
1 mol de O2
1 mol de O2
22.4 L O2
=
112 L O2

3. CaCl2 ? Ca + Cl2
Cuántos topos del metal de calcio se producen
¿de la descomposición de 8 mol del cloruro de calcio?
x mol Ca = 8 mol de CaCl2
1 mol de CaCl2
1 mol de Ca
=
8 mol de Ca
x mol
8 mol
Cuántos topos del metal de calcio y del gas de la clorina se producen
¿de la descomposición de 8 mol del cloruro de calcio?
mol de Cl x2 = 8 mol de CaCl2
1 mol de CaCl2
1 mol de Cl2
=
8 mol de Cl2
y gas de la clorina
+
clorina del calcio del cloruro de calcio

(Gp:) Pb2+
(Gp:) NO31
(Gp:) Na1+
(Gp:) I1
Iones en la solución acuosa
Pb (NO3)2(s)
Pb (NO3)2(aq)
Pb2+(aq) + NO 231(aq)
agregar
agua
NaI
+ H2O (l)
disociación:
+ H2O (l)
Na1+(aq) + I1(aq)
Mezclarlos y conseguir…
Balancear para conseguir la ecuación iónica total…
Cancelar los iones espectadores para conseguir la ecuación iónica neta…
NaI (aq)
(Gp:) NO31
(Gp:) Pb2+
(Gp:) NO31
(Gp:) NO31
en la solución
(Gp:) Na1+
(Gp:) I1

Mezclarlas y conseguir…
(Gp:) Pb2+(aq) + NO 231(aq)
(Gp:) + Na 21+(aq) + 2 I1(aq)
(Gp:) PbI2(s) + NO 231(aq)
(Gp:) + Na 21+(aq)
(Gp:) Pb2+(aq) + 2 I1(aq)
(Gp:) PbI2(s)
Pb (NO3)2(aq) + NaI 2 (aq)
PbI2(s) + NO 231(aq)
+ Na 21+(aq)
Balancear para conseguir la ecuación iónica total…
Cancelar los iones espectadores para conseguir la ecuación iónica neta…
sólido
en la solución
(Gp:) Pb2+
(Gp:) NO31
(Gp:) Na1+
(Gp:) I1
(Gp:) NO31
(Gp:) Na1+
(Gp:) I1
(Gp:) Pb2+
(Gp:) NO31
(Gp:) Na1+
(Gp:) I1
(Gp:) NO31
(Gp:) Na1+
(Gp:) I1
PbI2 + nano3
(s)
(aq)

(Gp:) Vagos2+
(Gp:) OH1
(Gp:) OH1
(Gp:) NO31
(Gp:) NO31
Zn de la mezcla junto (NO3)2(aq) y vagos (OH)2(aq):
Zn2+(aq) + NO 231(aq)
Vagos2+(aq) + 2 OH1(aq)
Vagos (OH)2(aq)
Zn (NO3)2(aq)
Balancear para conseguir la ecuación iónica total…
(Gp:) Zn2+
(Gp:) Zn (NO3)2(aq) + vagos (OH)2(aq)
(Gp:) Zn (OH)2(s) + NO 231(aq)
(Gp:) + vagos2+(aq)
(Gp:) Zn2+(aq) + NO 231(aq)
(Gp:) + vagos2+(aq) + 2OH1(aq)
(Gp:) Zn (OH)2(s) + NO 231(aq)
(Gp:) + vagos2+(aq)
Mezclarlos y conseguir…
(Gp:) Zn2+(aq) + 2 OH1(aq)
(Gp:) Zn (OH)2(s)
Cancelar los iones espectadores para conseguir la ecuación iónica neta…
Vagos (NO3)2 y Zn (OH)2
(aq)
(ppt)

Significado de coeficientes
2 Na + Cl2 NaCl 2
sodio de 2 g
1 clorina de g
cloruro sódico de 2 g
+
=
2 mol de sodio
1 mol de clorina
2 mol de cloruro sódico
(2 mol de Na) x (23 g/mol)
(1 mol de Cl2) x (71 g/mol)
(2 mol de NaCl) x (58.5 g/mol)
46 g
71 g
117 g
117 g
Na de 2 átomos
1 Cl de la molécula2
NaCl de 2 moléculas

Clases de reacciones
Reacciones químicas
Precipitación
reacciones
Ácido-Base
Reacciones
Oxidación-reducción
Reacciones
Combustión
Reacciones

Resumen de clases de reacciones
Reacciones químicas
Precipitación
reacciones
Ácido-Base
Reacciones
Oxidación-reducción
Reacciones
Combustión
Reacciones
Descomposición
reacciones
(Los productos son
elementos.)
Síntesis
reacciones
(Los reactivo son
elementos.)

Resumen de clases de reacciones
Reacciones químicas
Precipitación
reacciones
Ácido-Base
Reacciones
Oxidación-reducción
Reacciones
Combustión
Reacciones
Descomposición
reacciones
Síntesis
reacciones

VINCULACIÓN IÓNICA: Formación de cloruro del magnesio
Magnesio
Magnesio2+
Cl
Cl
Cl
Cl
Pierde 2e- que cada uno gana los iones del cloruro del ion dos del magnesio 1e- uno
Magnesio2+ Cl1
[(2+) 2 (1) = 0]
MgCl2 cloruro del magnesio

Magnesio2+
VINCULACIÓN IÓNICA: Formación de cloruro del magnesio
Magnesio2+
Cl
Cl
Cl
Cl
Pierde 2e- que cada uno gana los iones del cloruro del ion dos del magnesio 1e- uno
Magnesio2+ Cl1
[(2+) 2 (1) = 0]
MgCl2 cloruro del magnesio
 Página anterior Página anterior |   Volver al principio del trabajo Volver al principio del trabajo | Página siguiente  |