
Reacciones químicas
Usted debe poder a
Clasificar las reacciones por el tipo.
Escribir una ecuación molecular equilibrada, ecuación iónica completa,
y una ecuación iónica neta.
Reacciones de la oxidación-reducción del balance.
Predecir si un precipitado forma con las reglas de la solubilidad.
Predecir los productos de las reacciones dadas los nombres químicos del
reactivo.
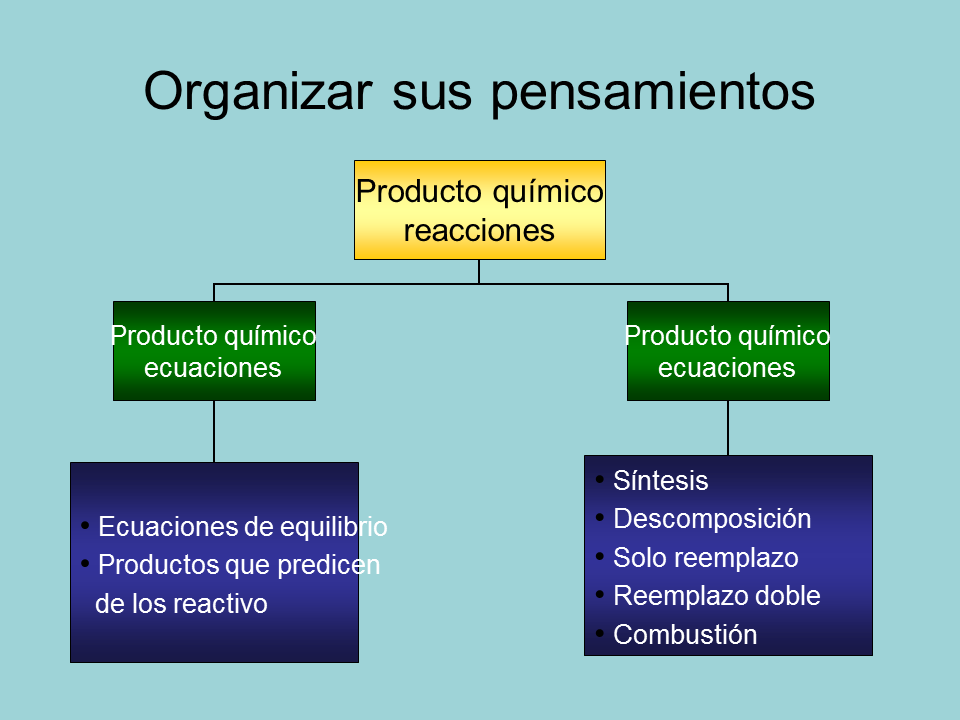
Organizar sus pensamientos
Producto químico
reacciones
Producto químico
ecuaciones
Producto químico
ecuaciones
Ecuaciones de equilibrio
Productos que predicen
de los reactivo
Síntesis
Descomposición
Solo reemplazo
Reemplazo doble
Combustión

Descripción de una reacción química
Indicaciones de una reacción química
Evolución del calor, de la luz, y/o del sonido
Producción de un gas
Formación de un precipitado
Cambio del color

Muestras de reacciones químicas
Hay cinco muestras principales que indican que ha ocurrido una reacción química:
cambiar en color
cambiar en olor
producción de nuevo
gases o vapor
entrada o lanzamiento
de la energía
difícil invertir
lanzamiento
entrada

Ecuaciones químicas
Representar la clase de reactivo y de productos
y sus cantidades relativas en una reacción.
(Gp:) 4 Al + 3 O2Al del (G) 22O3(s)
Los números en el frente se llaman
coeficientes estequiométricos.
Las letras (s), el (G), y (l) son
estados físicos de compuestos.
reactivo
producto
óxido de aluminio

Ecuaciones químicas
Esta ecuación significa:
(Gp:) 4 Al + 3 O2Al del (G) 22O3(s)
4 átomos del Al + 3 O2 moléculas de la producción 2 de las moléculas del Al2O3
4 topos del Al + 3 O2 topos de la producción 2 de los topos del Al2O3
o
Al de 4 g + 3 g O2 Al de g de la producción 22O3
4 mol de Al@27g/mol
3 mol de O2@32g/mol
2 mol de Al2O3@102g/mol
108 g + 96 g = 204 g
óxido de aluminio
papel de lija

Ecuaciones químicas
Porque los mismos átomos están presentes
en una reacción al principio (reactivo)
y en el extremo (productos), la cantidad
de materia en un sistema no cambia.
La ley de la conservación de la materia
Producto químico
Fábrica
100%
100%
el 80%
el 20%

Ecuaciones químicas
Debido a el principio de la conservación de la materia,
Una ecuación debe ser equilibrada.
Debe tener el mismo número de átomos
de la misma clase en ambos lados.
Lavoisier, 1788

Características de ecuaciones químicas
La ecuación debe representar sabido hechos.
La ecuación debe contener el correcto fórmulas para los reactivo y los productos.
La ley de la conservación de la masa debe satisfacerse.

Ecuaciones químicas
Reactivo – las sustancias que existen antes de a el cambio químico (o la reacción) ocurre.
Productos – las nuevas sustancias se forman que durante los cambios químicos.
La ECUACIÓN QUÍMICA indica los reactivo y productos de una reacción.
PRODUCTOS del ????? REACTIVO

Ecuaciones de palabra
UNA ECUACIÓN de PALABRA describe usar del cambio químico los nombres de los reactivo y de los productos.
Escribir la ecuación de palabra para la reacción del gas de metano con oxígeno-gas para formar el dióxido y el agua de carbono.
metano + oxígeno
Reactivo
Producto
CH4
O2
CO2
H2O
+
+
2
2
dióxido + agua de carbono

Cl
Cl
Cl
H
H
H
(Gp:) Cl
(Gp:) Cl
(Gp:) Cl
(Gp:) Cl
(Gp:) H
(Gp:) H
(Gp:) H
(Gp:) H
H2 + Cl2 ácido clorhídrico del ?
H2 + Cl2 ácido clorhídrico del ? 2
(Gp:)
(Gp:)
(Gp:) productos los reactivo
(Gp:) H
(Gp:) Cl
(Gp:)
(Gp:) productos los reactivo
(Gp:) H
(Gp:) Cl
2
2
2
2
2
2
1
1
(desequilibrado)
(balanceado)
Ecuaciones desequilibradas y equilibradas

Visualización de una reacción química
Na + Cl2 NaCl
2
2

Significado de la fórmula química
Producto químico
Composición del significado del símbolo
H2Molécula de O uno
del agua:
Dos átomos de H y un átomo de O
2 H2Moléculas de O dos
del agua:
Cuatro átomos de H y dos átomos de O
H2O2 Una molécula
del hidrógeno
peróxido:
Dos átomos de H y dos átomos de O

Ecuaciones químicas de equilibrio
Ecuación equilibrada – una en de el cual el número los átomos de cada elemento como reactivo son iguales a número de átomos de ese elemento como producto
Cuál es la relación entre la conservación de la masa y
el hecho de que una ecuación equilibrada tenga siempre iguales
¿número de átomos de cada elemento en ambos lados de una ecuación?
Determinar si la ecuación siguiente es equilibrada.
2 Na + H2? 2 de O NaOH + H2
2 Na + 2 H2? 2 de O NaOH + H2

Ecuaciones químicas de equilibrio
Escribir una ecuación de palabra para la reacción.
Escribir las fórmulas correctas para todos los reactivo y productos.
Determinar los coeficientes que hacen balance de la ecuación.
Página siguiente  |