
Sub Otros materiales.
Existen otras clasificaciones de materiales, como por materiales compuestos, que no son más que combinaciones de los materiales anteriormente mencionados.
Un ejemplo de eso son los cascos de algunas embarcaciones menores, hechos de fibra de vidrio mezclada con resinas poliméricas.
Otro material importante, por sus características eléctricas especiales, son los semiconductores, que tienen características tanto de conductores eléctricos como de aislantes. Son muy importantes en la industria de la electrónica, ya que son la base de sus circuitos.

Sub Otros materiales.
En los últimos años, la necesidad de hacer componentes cada vez más pequeños y livianos ha dado paso a nuevos desarrollos de materiales, dando paso a la disciplina de la nanotecnología, esto es, materiales a escala de los nanómetros (nm)

Son considerados la unidad fundamental de la naturaleza.
Constan de un núcleo de protones (carga eléctrica positiva), neutrones (sin carga) y una periferia de electrones (carga negativa).
El número de protones diferencia cada átomo en lo que se denominan los elementos químicos. Oficialmente, existen 104 elementos químicos.
Átomos

EII 441-01 Andrea Fredes
20
ESTRUCTURA DEL ÁTOMO
Cada elemento químico está constituido por átomos.
Cada átomo está formado por un núcleo central y 1 o más capas de electrones.
Dentro del núcleo residen partículas subatómicas:
protones (de carga +)
neutrones (partículas del mismo peso, pero sin carga).

EII 441-01 Andrea Fredes
21
ESTRUCTURA DEL ÁTOMO
NUCLEO
PROTONES
NEUTRONES
ELECTRONES

EII 441-01 Andrea Fredes
22
Los átomos grandes albergan a varias órbitas o capas de electrones.
el orbital más externo se llama la capa de valencia, porque determina cuantos enlaces puede formar un átomo
Los electrones giran alrededor del núcleo en regiones del espacio denominadas órbitas.

EII 441-01 Andrea Fredes
23
En el átomo distinguimos dos partes: el núcleo y la corteza
El núcleo es la parte central del átomo y contiene partículas con carga positiva, los protones, y partículas que no poseen carga eléctrica, es decir son neutras, los neutrones.
La masa de un protón es aproximadamente igual a la de un neutrón.
La corteza es la parte exterior del átomo. En ella se encuentran los electrones, con carga negativa.
Éstos, ordenados en distintos niveles, giran alrededor del núcleo.
La masa de un electrón es unas 2000 veces menor que la de un protón.

EII 441-01 Andrea Fredes
24
Todos los átomos de un elemento químico tienen en el núcleo el mismo número de protones.
Este número, que caracteriza a cada elemento y lo distingue de los demás, es el número atómico y se representa con la letra Z.
SIMBOLO DEL ELEMENTO
NUMERO ATOMICO
NUMERO MASICO
E
A
Z

NUMERO ATOMICO
NUMERO MASICO
La suma del número de
protones + neutrones
Número que es
igual al número total de
protones en el
núcleo del átomo.
Es característico de cada
elemento químico y
representa una
propiedad fundamental
del átomo:
su carga nuclear.
E
A
Z
EII 441-01 Andrea Fredes
25

EII 441-01 Andrea Fredes
26
PARA EL ELEMENTO QUE CONTIENE
Numero
atómico =Cantidad de protones en el núcleo = 79
Numero de
masa = Suma Protones + Neutrones= 197
Neutrones
=Numero de masa – Protones
= 197-79=118
Cantidad de electrones= Cantidad de protones= 79
Por esto es átomo es eléctricamente neutro
79 p
118n
Encuentre
EII 441-01 Andrea Fredes
27
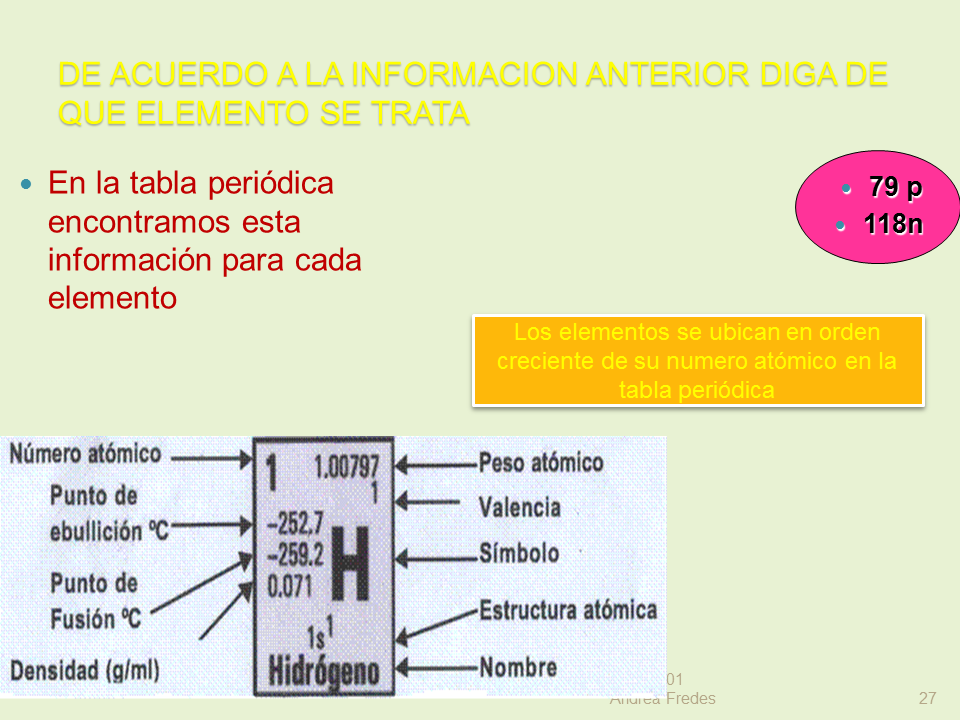
DE ACUERDO A LA INFORMACION ANTERIOR DIGA DE QUE ELEMENTO SE TRATA
En la tabla periódica encontramos esta información para cada elemento
79 p
118n
Los elementos se ubican en orden creciente de su numero atómico en la tabla periódica

EII 441-01 Andrea Fredes
28

EII 441-01 Andrea Fredes
29
El elemento de número atómico = 79 es
¿En que grupo está el elemento?
Au = oro
Está en el grupo IB por tanto es un metal de transición
¿En que periodo está el elemento?
1
2
3
4
5
6
7
Está en el periodo 6 , por tanto tiene 6 electrones en su ultima capa

EII 441-01 Andrea Fredes
30
DESARROLLE EL SIGUIENTE EJERCICIO
Numero atómico
Numero de masa
Cantidad de electrones
Neutrones
En que grupo y periodo esta el elemento
Si
28
14
Encuentre

EII 441-01 Andrea Fredes
31
ISOTOPOS
Aunque todos los átomos de un mismo elemento se caracterizan por tener el mismo número atómico, pueden tener distinto número de neutrones.
Llamamos isótopos a las formas atómicas de un mismo elemento que se diferencian en su número másico.

EII 441-01 Andrea Fredes
32
Veamos un ejemplo
Todos los átomos de Carbono tienen 6
protones en el núcleo (Z=6), pero solo:
El 98.89% de carbono natural tiene 6
neutrones en el núcleo A=12
Un 1.11% tiene 7 neutrones en el núcleo
A= 13.
Una cantidad aun menor 0.01% tiene 8
Neutrones A= 14
Todos los átomos de un elemento son idénticos en número atómico pero no en su masa atómica
Número atómico es igual al número total de
protones en el
núcleo del átomo
Masa atómica también peso atómico, es el promedio de las masa de los isotopos encontrados naturalmente de un elemento pesado de acuerdo con su abundancia
Los isotopos de un elemento son átomos que tienen diferente número de neutrones y por tanto una masa atómica diferente.

EII 441-01 Andrea Fredes
33
ISÓTOPOS DEL HIDRÓGENO
El número de neutrones puede variar, lo que da lugar a isótopos con el mismo comportamiento químico pero distinta masa. El hidrógeno siempre tiene un protón en su núcleo, cuya carga está equilibrada por un electrón.

Isóbaros
Son aquellos átomos que presentan igual número másico y distinto número atómico.
Ej:
6C14 y 7N14
EII 441-01 Andrea Fredes
34

Isótonos
Son átomos que presentan distinto número másico y distinto número atómico, pero tienen igual número de neutrones.
Ej:
5B11 y 6C12
EII 441-01 Andrea Fredes
35

Números cuánticos.
Número cuántico principal (n):
Designa el nivel de energía. Puede asumir cualquier valor positivo: 1,2…hasta el infinito. Cada valor de n determina un nivel o capa en el átomo. El primer nivel es el de menor energía y los siguientes, cada vez más alejados del núcleo, tienen energías mayores.
EII 441-01 Andrea Fredes
36
 Página anterior Página anterior |   Volver al principio del trabajo Volver al principio del trabajo | Página siguiente  |