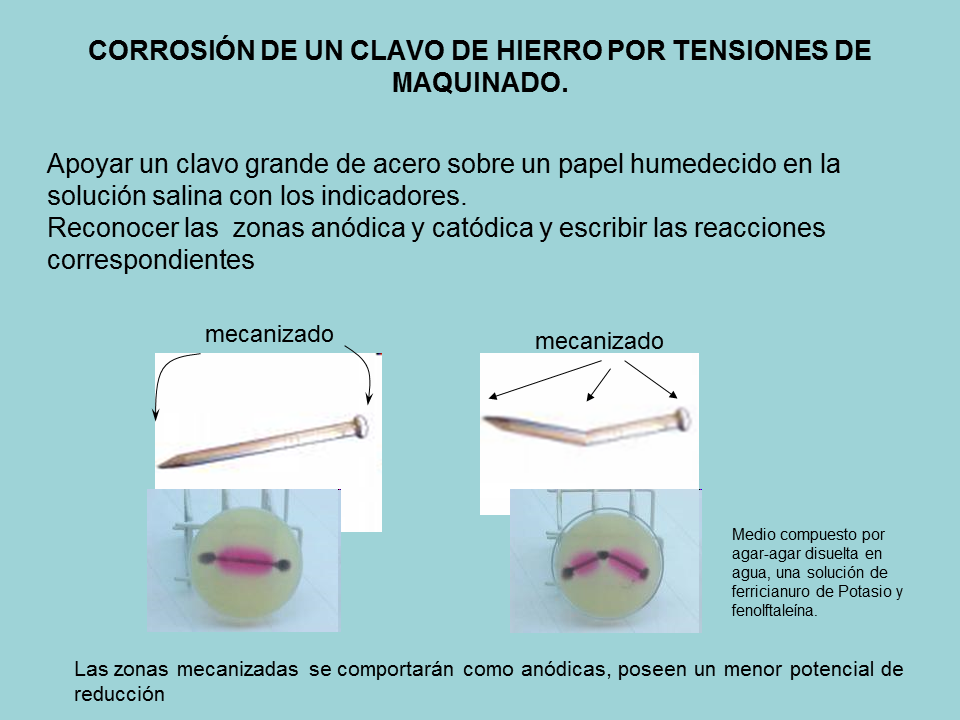
mecanizado
mecanizado
Las zonas mecanizadas se comportarán como anódicas, poseen un menor potencial de reducción
Medio compuesto por agar-agar disuelta en agua, una solución de ferricianuro de Potasio y fenolftaleína.
CORROSIÓN DE UN CLAVO DE HIERRO POR TENSIONES DE MAQUINADO.
Apoyar un clavo grande de acero sobre un papel humedecido en la solución salina con los indicadores.
Reconocer las zonas anódica y catódica y escribir las reacciones correspondientes

Ecuaciones de estado
Gases son el estado de agregación molecular más simple
Llenan completamente el recipiente que los contiene
Son totalmente solubles entre ellos
Ecuación de estado – ecuación que relaciona las variables que describen el estado físico del sistema
Ecuación de estado para un gas: p = f (T,V,n)
Propiedades de Gases (puros) – cuatro, pero con sólo tres especificamos el estado del sistema
Presión (p), Volumen (V), Temperatura (T), cantidad de sustancia (moles, n)

Presión, p, fuerza por unidad de área, N/m2 = Pa (pascal)
presión estándar = pø = 105 Pa = 1bar
Medida por manómetro (tubo abierto o cerrado), p = pexterna + rgh
g = 9.81 ms-2
Equilibrio mecánico – las presiones deben ser las mismas a uno y otro lado de las paredes
Volumen, V
m3, L
Cantidad de sustancia (número de moles), n
Temperatura, T, indica dirección del flujo de energía (calor)
Fronteras entre sistemas
Diatérmicas – permiten flujo de calor. Ocurre un cambio de estado cuando entran en contacto sistemas con diferentes temperaturas
Adiabáticas – no permiten el flujo de calor.
Ecuaciones de estado

Flujo de calor y equilibrio térmico
Equilibrio término – no ocurre ningún cambio cuando dos sistemas entran en contacto a través de fronteras diatérmicas
Ley Cero de la termodinámica – Si A está en equilibrio térmico con B y B está en equilibrio térmico con C entonces A se encuentra en equilibrio térmico con C
Justifica el uso de termómetros
Escalas de temperatura:
escala Celsius, t, · (°C)
escale Absoluta, escale termodinámica , (K no°K)
T (K) = t + 273.15
A
B
calor
Pared diatérmica
A
B
pared diatérmica
alta
Temp.
baja
Temp.
A
B
Pared adiabática
TA = TB
calor

Ecuación de estado ( p = f(V,T,N) Ley del Gas Ideal (gas perfecto)
Es una ecuación de estado, aproximada, para cualquier gas
pV = nRT; pVm = RT
R, constante general del edo. gaseoso, 8.31447 JK-1mol -1
Los gases se acercan más a este comportamiento cuando p ® 0. Es una ley límite
para n y V fijos, si T ® 0, p ® 0 linealmente
Casos particulares (antecedentes históricos): Ley de Boyle (1661), Ley de Charles [Gay-Lussac (1802-08)]; principio de Avogodro (1811)
Muy importante a STP (T= 298.15, p = pø =1bar), V/n (volumen molar) = 24.789 L/mol

Para una cantidad fija de gas (n constante) la gráfica pVT genera una superficie
Isobara – presión constante – recta, V a T
Isoterma – temperatura constante, hipérbola, pV = constante
Isocora – volumen constante – recta p a T
http://www.chem1.com/acad/webtext/gas/gas_2.html#PVT
Ecuación de estado ( p = f(V,T,N) Ley del Gas Ideal (gas perfecto)

Resumen Leyes de los Gases

Ley de Dalton de las presiones parciales
V y T son constantes
p1
p2
ptotal = p1 + p2

Considera el caso en el que dos gases, A y B, están en un recipiente de volumen V a T constante.
(Gp:) pA =
(Gp:) nART
(Gp:) V
(Gp:) pB =
(Gp:) nBRT
(Gp:) V
nA es el número de moles de A
nB es el número de moles de B
pT = pA + pB
(Gp:) XA =
(Gp:) nA
(Gp:) nA + nB
(Gp:) XB =
(Gp:) nB
(Gp:) nA + nB
pA = XA pT
pB = XB pT
pi = Xi pT

Considera el siguiente aparato. Calcula las presiones parciales de helio y de neón después de abrir la válvula. La temperatura se mantiene constante.
He
Ne
1.2 L, 0.63 atm
3.4 L, 2.8 atm

El etileno gaseoso, C2H4, reacciona con gas hidrógeno en presencia de un catalizador de Pt para formar etano, C2H6, según
C2H4(g) + H2(g) C2H6(g)
Una mezcla de C2H4 y H2 de la que sólo se sabe que contiene más moles de H2 que de C2H4 tiene una presión de 52 torr en un volumen desconocido. Después de haber pasado la mezcla por un catalizador de Pt, su presión es de 34 torr en el mismo volumen y a la misma temperatura ¿qué fracción molar de la mezcla original era etileno?
 Página anterior Página anterior |   Volver al principio del trabajo Volver al principio del trabajo | Página siguiente  |