
Contenido
Composición del aire
Presión Atmosférica
Presión manométrica
Unidades de Presión
Fuerza de un cilindro
Leyes de los gases
Temperatura constante
Presión constante
Volumen constante
Ley General de los gases
Compresion Adiabática
Agua en el aire comprimido
Intercambiadores de Calor
Enfriado
Caudal en las válvulas
Escalas de Temperatura
Compresion Politrópica
Humedad Relativa
Principio de Pascal

Composición del aire
Composición
Nitrogeno 78.09% N2
Oxígeno 20.95% O2
Argón 0.93% Ar
Otros 0.03%

Presión atmosférica
Debida al peso del aire encima nuestro
Disminuye si
subimos una montaña
Aumenta si
bajamos a una mina
También varia por condiciones del clima

Presión atmosférica
La presión absoluta y temperatura al nivel del mar son 1.01325 bars y 288 K (15OC), respectivamente
1013.25 m bar

Barómetro de Mercurio
La presión atmosférica puede medirse por la altura de una columna al vacío de un liquido
Al nivel del mar una columna de mercurio alcanza una altura de 760 mm Hg (1.0139 bar)
Una columna de agua mediría 10 mts. Pero el mercurio es mucho más denso que el agua
760 mm Hg
Presión atmosférica

Barómetro de Mercurio
DENSIDADES (Kg /m3)
Aire 1.25
Alcohol 806
Agua 1000
Mercurio 13600
(el mercurio es 10880 veces más denso que el aire)
760 mm Hg
Presión atmosférica

Presión Manométrica (Pg)
En los sistemas neumáticos la presión se mide con manómetros
La presión manométrica indica la presión en exceso a la presión atmosferica
La graduación de los manómetros se da generalmente en bar
(en equipo inglés en PSI)

Presión Manométrica (Pg)
La presión manométrica indica la presión en exceso a la presión atmosferica
Presión manométrica cero es igual a la presión atmosférica
En los cálculos con las fórmulas se usan presiones absolutasPa = Pg + 1 atmósfera
Aunque en realidad 1 atmósfera es igual a 1.013 bar, se asume que 1 atmósfera es igual a 1 bar
(Gp:) Presiones
Bajas
(Gp:) Presiones
típicas
0
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
0
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
Presión absoluta bar a
Presión manométrica bar g
Vacío
atmósfera
Rango
extendido
de
presiones

Unidades de Presión
1 Pascal = 1 N / m2
1 bar = 100,000 Pascal
1 bar = 10 N / cm2
Si se usan libras por pulgada cuadrada (psi)
1 psi = 68.95 mbar14.5 psi = 1bar

Unidades de Presión
1 bar = 100000 N/m2
1 bar = 100 kPa
1 bar = 14.50 psi (100 psi = 6.9 bar)
1 bar = 10197 kgf/m2
1 mm Hg = 1.334 mbar aprox.
1 mm H2O = 0.0979 mbar aprox.
1/10 bar (10,000 Pa) es aprox. lo más fuerte que una persona promedio puede soplar

Principio de Pascal
La presión de los fluidos se transmite por igual en todas las direcciones
La fuerza ejercida por un piston es igual al producto del area efectiva por la presión del aire
PRESION = FUERZA
AREA
Por tanto si la presión suministrada es constante, a mayor diámetro D del cilindro mayor fuerza F para el trabajo
D mm
P bar
F

Fuerza de un cilindro
La fuerza ejercida por un pistón es igual al producto del area efectiva por la presión del aire
Fuerza
=
D2
40
P
Newtons
p
D mm
P bar
donde
D = diámetro del cilindro en mm
P = presión en bar

Escalas de Temperatura
-40
-20
0
20
40
60
80
100
120
233
253
273
293
313
333
353
373
393
OK = OC + 273.15
OF = 9/5 OC + 32
Fahrenheit y Celsius coinciden a – 40O
OK
-40
-20
0
20
40
60
80
100
120
140
160
180
200
220
240
OF
OC

Leyes de los gases
Las variables de estado de los gases son: presión, volumen y temperatura
Si mantenemos una de ellas constante, la relación de las otras dos esta dada por las siguientes leyes:
Temperatura constante P.V = constante
(Ley de Boyle)
Presión constante V / T = constante (Ley de Charles)
Volumen constante P / T = constante
(Ley de Gay – Lusac)

Temperatura constante
Ley de Boyle: el producto de presión y volumen de una masa de gas se mantiene si la temperatura no se varía
Este proceso se llama Isotérmico. Debe ser lento para que el calor fluya libremente y así la temperatura no cambie, cuando el gas es comprimido o expandido
0
2
4
6
8
16
0
2
4
6
8
10
12
Volumen V
Presión P
bar (absoluta)
P1.V1 = P2.V2 = constante
10
12
14
14
16
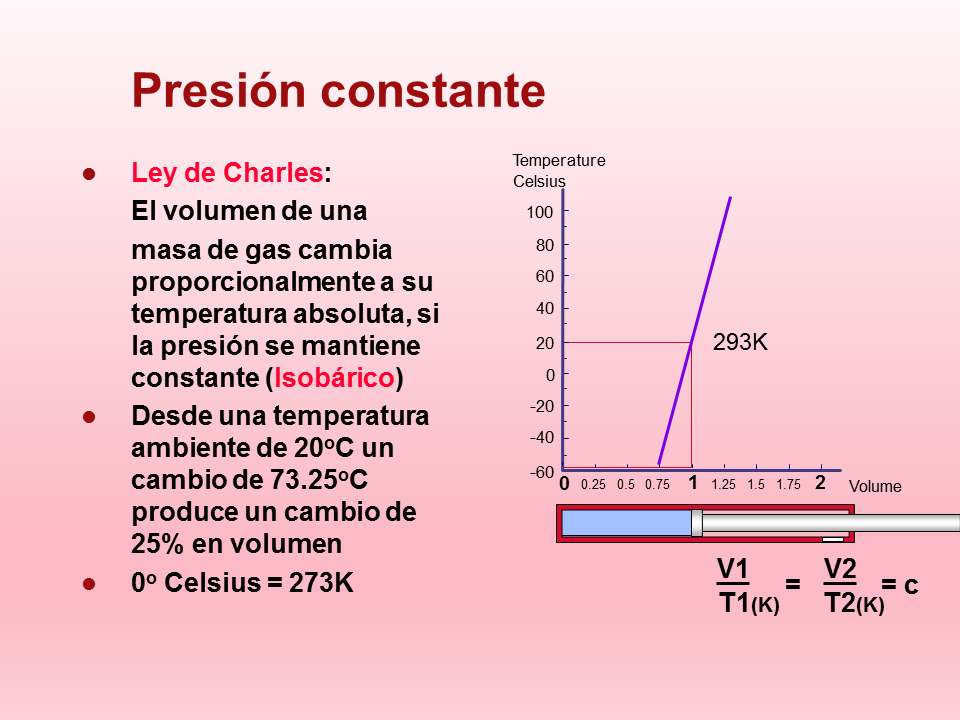
Presión constante
Ley de Charles:
El volumen de una
masa de gas cambia proporcionalmente a su temperatura absoluta, si la presión se mantiene constante (Isobárico)
Desde una temperatura ambiente de 20oC un cambio de 73.25oC produce un cambio de 25% en volumen
0o Celsius = 273K
0
0.25
0.5
0.75
1
2
-60
-40
-20
0
20
40
60
Volume
Temperature
Celsius
1.25
1.5
1.75
80
100
293K
(Gp:) V1 V2
(Gp:) T1(K) T2(K)
(Gp:) = c
(Gp:) =
Página siguiente  |