Algo a tener en cuenta es la existencia de
los grupos alquilos, los cuales están formados por la
eliminación de un átomo de hidrógeno en la
molécula de un hidrocarburo saturado. Estos grupos se
encuentran unidos a otos átomos o grupos de átomos.
Se nombran cambiando la terminación ano del
alcano por el sufijo il o ilo. Por
ejemplo, si a la molécula de metano (CH4) se le elimina un
átomo de hidrógeno se obtiene el grupo
metil o metilo -CH3; de la molécula de
etano se forma el grupo etil o
etilo (C2H5), y así sucesivamente.De
cadena ramificada: Los hidrocarburos saturados de cadena
ramificada se nombran regidas por las siguientes
reglas:
1. Se selecciona la cadena
más larga o cadena principal y se numera empezando por
el extremo que tenga más cerca una
ramificación. Si hay dos ramificaciones igualmente
distantes de los extremos, se comienza a numerar a partir del
más próximo a la más
sencilla.2. Se nombran los grupos alquilos
en orden alfabético, indicando con un número si
es necesario, la posición en la cadena
principal.3. Los números se separan
de los nombres de los radicales mediante guiones y cuando hay
varios números se separan por comas. Los nombres de
los grupos se agregan como sufijos al nombre básico de
la cadena principal.
Nomenclatura y
notación química de hidrocarburos no
saturados
Alquenos: Para nombrarlos se utilizan los
mismos prefijos que en los alcanos seguido del sufijo
eno, y teniendo en cuenta estas reglas:
1. Se selecciona la cadena
más larga que contenga el doble enlace.2. Se numera la cadena, comenzando
por el extremo más cercano al doble enlace.3. En el caso de los alquenos de
cuatro o más átomos de carbono se indica la
posición del doble enlace con un número, el
cual se coloca antes del nombre de la cadena principal,
separado por un guión.4. Si la cadena es ramificada se
nombran los grupos alquilo en orden alfabético,
indicando con un número, si es necesario, su
posición en la cadena principal. en tal caso, se
procede igual que en los alcanos, teniendo presente las tres
reglas anteriores.5. Si en la cadena existe otro
tipo de constituyente, como los halógenos, entonces el
alqueno se nombra de forma análoga a como se hace en
los derivados halogenados de los alcanos según las
reglas antes mencionadas.
Ejemplo 1:

Ejemplo 2:

Ejemplo 3:

Alquinos: Para estos compuestos su
nomenclatura solo se diferencia de los alquenos en la
terminación, pues se coloca
ino.
Derivados halogenados
1.- Derivados halogenados.
Son hidrocarburos que contienen en su molécula
átomos de halógeno. Se nombran a veces como haluros
de alkilo
Los derivados halogenados o compuestos halogenados, como
su nombre lo dice son compuestos que contienen halogenos. Algunos
de los compuestos halogenados son los hidrocarburos halogenados,
o sea, los hidrocarburos con halogenos (clorometano,
difluoropentano).
Los compuestos halogenados pertenecen al grupo funcional
de los átomos de halógeno. Tienen una alta
densidad. Son usados en refrigerantes, disolventes, pesticidas,
repelentes de polillas, en algunos plásticos y en
funciones biológicas: hormonas tiroideas. Por ejemplo:
cloroformo, diclorometano, tiroxina, Freón, DDT, PCBs,
PVC. La estructura de los compuestos halogenados es: R-X, en
donde X es Flúor (F), Cloro (Cl), Bromo (Br) y Yodo
(I)
2.- Normas a seguir para asignarles nombres a los
derivados halogenados.
Se nombran anteponiendo el nombre del halógeno
(fluoro, cloro, bromo, yodo) al del hidrocarburo correspondiente
con el número que indica su posición. Si se
encuentra un sustituyente en la cadena lateral, se numera
entonces ésta principiando por el átomo de carbono
unido a la cadena principal; la cadena lateral se encierra en un
paréntesis La posición de los átomos de
halógeno se indica por medio de localizadores.
Ejemplos:

Si existen dobles y triples enlaces, se numera la cadena
de modo que a las instauraciones les correspondan los
localizadores más pequeños.
Al nombrar los derivados halogenados de cadena
ramificada, los halógenos se consideran como radicales y
se citan en el lugar que les corresponde según el orden
alfabético.
Ejemplos:

3.- Escribir el nombre de los siguientes derivados
halogenados:

4.- Escribe las fórmulas estructurales de los
siguientes derivados halogenados:

Compuestos
Oxigenados de los Hidrocarburos
Alcoholes:
Clasificación. Series homólogas. Nomenclatura y
notación química. Propiedades físicas.
Isomería.
Los alcoholes son compuestos
orgánicos constituidos por carbono, oxígeno e
hidrógeno, y que presentan en su estructura uno o
varios grupos hidroxilos (-OH) unidos a la cadena carbonada.
Esta cadena carbonada o grupo alquilo puede estar ramificada
o sustituida y ser abierta o
cíclica.Clasificación:Atendiendo a su
estructura se clasifican según el número de
grupos hidroxilos en la cadena carbonada y el tipo de carbono
al cual está unido el grupo -OH.Según el
número de grupos hidroxilos en la cadena carbonada
pueden ser alcoholes monohidroxilados (poseen un grupo -OH) y
alcoholes polihidroxilados (tienen más de un grupo
-OH). Ejemplos de estos se muestran a
continuación:Monohidroxilados: CH3 – OH (Metanol o
alcohol metílico)Polihidroxilados: OH – CH2 – CH2 – OH
(1,2-etanodiol o etilenglicol)Si en la cadena carbonada de un
hidrocarburo se sustituye un átomo de hidrógeno
por un grupo hidroxilo, resulta un alcohol
monohidroxilados.Los alcoholes polihidroxilados con dos
grupos hidroxilos unidos a la cadena carbonada se nombran
dioles o glicoles, y con tres, trioles. estos no son
más que la sustitución de dos y tres
átomos de hidrógeno, respectivamente, en la
molécula de un hidrocarburo, por igual cantidad de
grupos hidroxilos.En los alcoholes polihidroxilados los
grupos – OH está unidos a diferentes átomos de
carbono ya que dos grupos hidroxilos enlazados a un mismo
átomo de carbono dan lugar a un compuesto
inestable.Según el tipo de carbono al cual está
unido el grupo – OH los alcoholes pueden ser primarios,
secundarios y reciarios.En los alcoholes primerios el grupo
hidroxilo (-OH) está unido a un carbono primario en
los alcoholes secundarios, a un carbono secundario, y en los
alcoholes terciarios, a un carbono terciario, los cuales se
pueden representar de forma general así:

En las representaciones anteriores los
grupos -R (cadenas carbonadas o grupos alquilos) pueden ser
iguales o diferentes.A continuación un ejemplo de cada uno
de estos alcoholes:

Series homólogas:En la
siguiente tabla se ofrecen varios ejemplos de la serie
homóloga del etanol:

Propiedades físicas: De manera semejante a lo que ocurre en las series
homólogas de los hidrocarburos estudiados, las propiedades
físicas de los alcoholes varían con el aumento de
la masa molar. La temperatura de ebullición y la densidad
aumentan consecutivamente a medida que se incrementa el
número de grupos metileno.De los valores de las
temperaturas de ebullición y de fusión se puede
deducir que a temperatura y presión ambientes no existen
alcoholes en estado gaseoso. En estas condiciones los alcoholes
de hasta doce átomos de carbono son líquidos y los
demás sólidos. Los alcoholes poseen una densidad
mayor que la de los alcanos respectivos, pero todavía son
menos densos que el agua.La solubilidad de los alcoholes en agua
disminuye con el aumento de la masa molar. Los alcoholes de hasta
cuatro átomos de carbono son solubles en agua. A medida
que aumenta la cadena carbonada predomina la parte apolar en la
molécula y, por eso, disminuye la solubilidad en agua y
aumenta la solubilidad en disolventes apolares.
Nomenclatura y
notación química de los alcoholes
monohidroxilados.
Según la IUPAC, las reglas para
nombrar los alcoholes monohidroxilados son:
1ro. Se selecciona la cadena
carbonada más larga que contenga el grupo
-OH.
2do. Se numera la cadena comenzando
por el extremo más cercano al átomo de carbono que
está unido al grupo hidroxilo.
3ro Se indica la posición del
grupo hidroxilo con un número (en los alcoholes con
más de dos átomos de carbono), el cual se coloca
antes del nombre de la cadena principal separado por un
guión.
4to. Si la cadena es ramificada se
procede de igual forma que en el caso de los hidrocarburos. 5to.
Se cambia el nombre del alcano correspondiente a la cadena
carbonada principal sustituyendo la o final por
la terminación ol.

Los alcoholes simples también se
conocen por sus nombres comunes, los cuales se forman con la
palabra alcohol seguida del grupo alquímico. Por ejemplo,
alcohol metílico (metanol), alcohol etílico
(etanol), alcohol propílico (1-propanol),
etcétera.
* Isomería de
cadena.
La isomería de cadena de dichos
compuestos se manifiesta en las diferentes estructuras de
alcoholes de igual composición cualitativa y cuantitativa,
como consecuencia de la existencia de ramificaciones en la cadena
carbonada de uno o más de estos.

El orden de unión de los
átomos en las moléculas de uno de los compuestos
representados es diferente al de los otros dos.
*Isomería de
posición.
Este tipo de isomería consiste en la
diferente posición del grupo funcional en este caso
el
grupo -OH en la cadena carbonada de
los alcoholes que tienen la misma composición cualitativa
y cuantitativa:

* Isomería de
función.
Los isómeros de función son
compuestos que presentan la misma composición
cualitativa
y cuantitativa, pero distinto grupo
funcional.

Aldehídos y
Cetonas: Clasificación. Series
homólogas. Nomenclatura y notación química.
Propiedades físicas. Isomería.
Los aldehídos y las cetonas, al
igual que los alcoholes, son compuestos orgánicos
oxigenados. En la naturaleza se encuentran muchos
aldehídos de masas molares altas, por ejemplo, el octanal
(C8H16O); el nonanal (C9H18O) y el decanal (C10H20O) que se
encuentran como componentes de algunos aceites esenciales
contenidos en flores y plantas a las cuales proporcionan el olor
característico, ¿Cuál es el grupo funcional
de estas sustancias? ¿Qué influencia tiene este en
las propiedades físicas de los aldehídos y las
cetonas? ¿Qué tipo de isomería
presentan?
Los aldehídos y las cetonas son
aquellos compuestos que poseen el grupo carbonilo C = O, que es
uno de los grupos más importantes en la química
orgánica. Por tal razón, frecuentemente se les
denomina compuestos carbonílicos.
Serie
homóloga.
Los aldehídos presentan el grupo
carbonilo enlazado a un átomo de carbono y a otro de
hidrógeno (menos en el caso del primer representante de la
serie homóloga en el cual el grupo está asociado a
dos átomos de hidrógeno). Las cetonas son
compuestos en los que el grupo carbonilo está enlazado a
dos átomos de carbono.

La fórmula general de los
aldehídos es RCHO y la de las cetonas es
RR'CO.
El primer representante de la serie
homóloga de los aldehídos es el metanal o
formaldehído y el de las cetonas es la
propanona.
Representación, nombre y varias
propiedades físicas de algunos miembros de las series
homólogas del metanal y de la propanona.

Nomenclatura y
notación química de los aldehídos y las
cetonas
En el sistema de la UIQPA (en inglés
IUPAC) los nombres de los aldehídos alifáticos se
forman sustituyendo la o final del nombre del alcano
correspondiente por la terminación al.
Como el grupo carbonilo está en uno
de los extremos de la cadena de átomos de carbono, no es
necesario indicar su posición, ya que es propia de un
carbono primario al que se le asigna el Nro1. Cuando se
encuentran presentes otros sustituyentes es necesario
señalar la posición que estos ocupan.
Muchos aldehídos también
reciben nombres comunes. En los ejemplos siguientes estos se
representan entre paréntesis:

Los nombres de las cetonas
alifáticas se forman sustituyendo la o del nombre del
alcano correspondiente con la terminación ona. Entonces se
numera la cadena de forma tal, que el grupo carbonilo tenga el
menor número posible y se utiliza este número para
indicar su posición.
Isomería de
cadena en los aldehídos y en las cetonas.


Isomería de
posición
Entre las cetonas de más de cuatro
átomos de carbono se manifiesta la isomería de
posición. Este tipo de isomería se presenta entre
cetonas de igual fórmula global, en las que el grupo
carbonilo se encuentra en diferentes posiciones en la cadena
hidrocarbonada.

Isomería de
función.
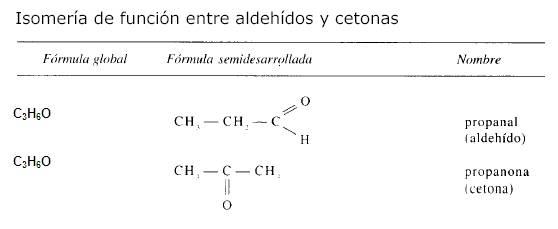
Los aldehídos y las cetonas de igual
composición cualitativa y cuantitativa son isómeros
de unión
Acido
Carboxílicos: Ácidos monocarboxílicos. Serie
homóloga. Propiedades físicas.
Estructura.
Los ácidos orgánicos
monocarboxílicos son compuestos que poseen, en la cadena,
al menos, un

a un grupo alquilo. Si el grupo fuese
aromático se escribiría Ar. La cadena puede ser
lineal, ramificada o cíclica. Los ácidos
alifáticos con un grupo carboxilo, reciben el nombre de
ácidos grasos, pues muchos se pueden obtener por la
hidrólisis de las grasas (las grasas son sustancias que
forman el tejido adiposo de los animales, también se
encuentran en los vegetales, en las semillas y en algunos
frutos).
Serie
homóloga
En la tabla se presentan los cinco primeros
ácidos de cadena lineal, donde se observa la diferencia de
un grupo metileno (CH2), entre miembros vecinos.


Propiedades
físicas.
Los ácidos alifáticos
saturados que tienen hasta 10 átomos de carbono son
líquidos, en tanto los homólogos superiores son
sólidos a temperatura ambiente.
Las temperaturas de ebullición
aumentan con el incremento de los grupos CH2, si se comparan con
las de los alcoholes de igual número de átomos de
carbono se observa que la de los Ácidos
monocarboxílicos son mayores.
Las temperaturas de fusión
varían de forma irregular, como se muestra en el
gráfico. En la serie de los ácidos
alifáticos, la densidad disminuye con el alargamiento de
la cadena pues influye más el volumen de la
molécula que la masa representada por el incremento del
grupo metileno (CH2 ).
Estructura.
La fórmula electrónica de un
ácido rnonocarboxílico se representa de la forma
siguiente:

Temperaturas de fusión de los
ácidos monocarboxílicos con respecto al
número de átomos de carbono en la
molécula.
Compuestos
nitrogenados de los Hidrocarburos
« Compuestos nitrogenados de
los
hidrocarburos : : : Aminas.
Clasificación
Las aminas son compuestos orgánicos
nitrogenados que pueden considerarse como derivados del amoniaco,
en el que se han sustituido uno o más átomos de
hidrógeno por grupos (alquilos o arilos). Atendiendo a su
estructura se clasifican en:a) Aminas primarias,
secundarias y terciarias en dependencia del número de
átomos de hidrógeno sustituidos en la
molécula de amoníaco, por grupos alquilos o arilo.
Las aminas primarias presentan un grupo alquilo o arilo, las
secundarias dos y las terciarias tres. Los grupos sustituyentes
R, R', R'' pueden ser iguales o diferentes. En la siguiente tabla
puede verse una representación de lo anteriormente
expuesto.

b) Aminas alifáticas y
aromáticas, según el tipo de sustituyentes: las
aminas son alifáticas si R, R' y R'' son grupos alquilo, y
aromáticos si al menos uno de estos grupos es
arilo.Ejemplos:

Aplicación de
las sustancias orgánicas
Alcoholes:
? Solventes
? Intermediarios Químicos
? Farmacéutico
? Componente Estimulante e Intoxicante
Éteres:
? Anestésico
? Disolvente
? Extractor Ácidos
Carboxílicos:
? Preparación de vinagre, esteres,
sales, esencias artificiales, colorantes, jabones,
cosméticos, lubricantes Aldehídos y
Cetonas
? Obtención de resinas
sintéticas
? Antiséptico
? Conservación de piezas
anatómicas
? Embalsamamiento
? Funguicida
? Desodorante
? Obtención de Exógeno o
Ciclonita (explosivos)
? Disolvente
? Preparación de Resinas
Vinílicas
? Preparación de Pólvoras sin
humo
? Obtención de Cloroformo y
Yodoformo Aminas:
? Producción de productos
farmacéuticos
? Anestésico local
? Fabricación de Nylon
? Contra las infecciones de estreptococos,
estafilococos y bacterianas Esteres
? Preparación de esencias y
perfumes, margarinas, lacas, pinturas de autos, pinturas de
planos, pulidores, matrices para discos, jabones
Amidas:
? Fabricación de Nylon
? Repelente de Insectos
? Anestésico
Unidad #2
Clasificación de las
sustancias
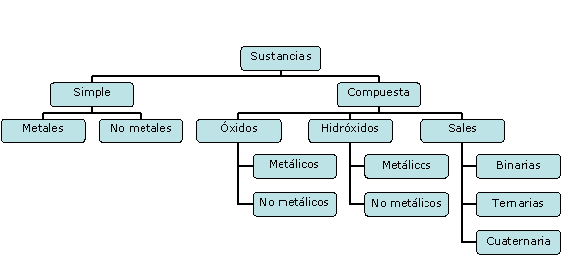
Existen dos criterios fundamentales para
clasificar las sustancias, uno es según la
composición y el otro considera el tipo de
partícula que la constituye. Considerando la
composición, las sustancias se clasifican en simples
(formadas por átomos de un mismo elemento químico)
y compuestas (formada por átomos de dos o más
elementos diferentes). Esto se resume en el siguiente
esquema.
Según el tipo de partículas o
entidades elementales ( átomo, molécula, ion) las
sustancias se clasifican en atómicas, iónicas y
moleculares.
Esta otra clasificación que tiene en
cuenta el tipo de enlace, pero que se tiene en cuenta en la
relación estructura propiedad y tipo de enlace de las
sustancias, lo cual se refleja en los siguientes
cuadros:





Resumen:
Las sustancias se clasifican en simples
y compuestas según la composición.Las sustancias se clasifican en
atómicas, moleculares e iónicas según el
tipo de partículas.Las sustancias simples pueden ser
atómicas o moleculares.Las sustancias compuestas pueden ser
atómicas, moleculares o iónicas.
2.2 Nomenclatura y notación
química de las sustancias.
Se denomina Notación química
y Nomenclatura al conjunto sistemático de reglas para
nombrar y formular sustancias. La fórmula química
es la representación escrita convencional de la
composición de una sustancia a partir de los
símbolos de los elementos que la constituyen. Estas reglas
en su aplicación dependen de la clasificación de
las sustancias según su composición y tipo de
partículas.
Recordemos los prefijos que indican
números:
Mono, di, tri, tetra, penta, hexa, hepta,
octa, nona, deca, undec, dodec, tridec.
Las sustancias simples se clasifican en
metales y no metales y pueden ser atómicas o moleculares,
¿cómo nombrarlas?
Sustancias simples atómicas: El
nombre coincide con el del elemento que la constituye y la
fórmula con el símbolo del elemento tanto
metálico como no metálico.
Ejemplos:
Nombre
Fórmula
Aluminio
Al
Carbono
C
Sodio
Na
Silicio
Si
Boro
B
Magnesio
Mg
Cobre
Cu
Plata
Ag
Oro
Au
Sustancias simples moleculares: Se nombran
similar a las atómicas, pero anteponiéndole al
nombre un prefijo que indica la cantidad de átomos que
forman la molécula. En la fórmula este
número se indica con un sudíndice.
Ejemplos

Las sustancias compuestas:
¿cómo se nombran y formulan?
Recordemos que estas se clasifican
según su composición en óxidos,
hidróxidos y sales.Generalmente se tienen en cuenta dos
criterios:
a)
El número de partículas que se presentan en la
fórmula.
b)
El número de oxidación del átomo del
elemento que forma la sustancia cuando este es
variable.
Nomenclatura y notación
química de los óxidos.
El primer criterio se emplea generalmente
para los óxidos no metálicos y el segundo para los
óxidos metálicos.
Óxido metálico: Se nombran
con la palabra genérica óxido seguida de la
preposición de y a continuación el nombre del
elemento metálico ( si el elemento tiene número de
oxidación variable se coloca el valor absoluto del
número con un número romano entre
paréntesis).
Ejemplo:

Para su notación se escribe el
símbolo del elemento metálico primero y a
continuación el del oxígeno. Se coloca como
subíndice el valor absoluto de los números de
oxidación de cada elemento intercambiado, y si son
divisibles por un mismo número se dividen.
Ejemplo:

Óxido no metálico: Se nombran
similar a los óxidos metálicos, pero empleando
prefijos que indican el número de átomos de cada
elemento en la fórmula química.
El prefijo mono para el no metal
suele omitirse al igual que el número 1 como
subíndice.
Ejemplo

Para notarlo se hace de forma similar a los
óxidos metálicos, pero colocando solo los
subíndices que como prefijo en el nombre indican el
número de átomos de cada elemento.
Ejemplo:

En resumen la nomenclatura y la
notación química de los óxidos se ve
reflejada en el siguiente cuadro:

Nomenclatura y notación
química de las sales.
Las sales son sustancias iónicas
neutras, es decir formadas por iones negativos y positivos. Los
iones pueden ser monoatómicos (un solo átomo: Cl- ,
Mg2+) o poliatómicos (varios átomos: NO3 , SO4).
Las sales según su composición pueden ser binarias
(átomos de dos elementos: NaCl), ternarias (átomos
de tres elementos: Na2SO4) y cuaternarias (átomos de
cuatro elementos: NaHCO3).
En general las sales se nombran de la
siguiente forma:
Nombre del anión,
preposición de, nombre del catión. ( Si el
catión del elemento metálico tiene número
de oxidación variable, se coloca el valor absoluto del
mismo con un número romano entre
paréntesis).
Sales binarias: En ellas el anión es
monoatómico y se escribe el nombre del elemento no
metálico terminado en uro.
Ejemplo:

Para formular las sales binarias se escribe
la fórmula del catión y luego la del
anión y se colocan como subíndice el valor
absoluto de la carga de cada ion intercambiada y si son
divisibles por un mismo número de divide.

Sales ternarias: Para
nombrar o notar se procede de forma similar a las sales binarias,
cambiando solamente el nombre del anión que en este caso
es un ion poliatómico. Poliatómico.
Ejemplos:

Ejemplo:

Hidróxidos
Los hidróxidos se clasifican en
metálicos o no metálicos, y ambos grupos difieren
en sus propiedades químicas. Así, los
hidróxidos metálicos generalmente tienen
propiedades básicas, y los hidróxidos no
metálicos propiedades ácidas. En función de
ello, en la nomenclatura y notación química se
utilizan dos criterios diferentes:
a) Hidróxidos metálicos: son
generalmente compuestos iónicos, y como tal se nombran y
formulan. En este caso el anión es el
hidróxido; así tenemos, por ejemplo:

b) Hidróxidos no metálicos:
son generalmente sustancias moleculares, que manifiestan
propiedades ácidas, liberando con facilidad el ion
hidronio H+ en disolución, por lo que se nombran
como ácido, es decir, con la palabra
genérica ácido, seguida del nombre del anión
poliatómico, cambiando la terminación -ato por -ico
o la terminación -ito por -oso.

Notación: Se escribe primero el
símbolo del hidrógeno (H), seguido de la
representación o fórmula del anión y
se coloca como subíndice del hidrógeno el valor
absoluto de la carga del anión (siempre existe un solo
anión para estos hidróxidos).
Ejemplo:

La aplicación de la nomenclatura y
notación química de las sustancias quedan resumidas
en el siguiente cuadro, donde se ejemplifican diferentes clases
de sustancias con su nombre y fórmula
química.

2.3 Las reacciones
químicas.
Las reacciones químicas son procesos
en los cuales tienen lugar cambios estructurales, tales como el
rompimiento y la formación de nuevos enlaces
químicos, que originan nuevas sustancias y que transcurren
con absorción o liberación de energía
calorífica.
Entre las manifestaciones que pueden
evidenciar la ocurrencia de una reacción química se
señalan las siguientes:
* Cambios de coloración.
* Aparición o desaparición de
un sólido.
* Desprendimiento de un gas.
* Variación de la conductividad
eléctrica.
* Desprendimiento de energía en
forma calor.


Una reacción química
se representa mediante una ecuación química.
La interpretación cualitativa de la
ecuación química expresa cualitativamente la
naturaleza de las sustancias reaccionantes y productos, y desde
el punto de vista cuantitativo expresa las relaciones de
proporcionalidad entre las distintas magnitudes que caracterizan
las muestras de sustancias [N(x), n(x), m(x), v(x)] por lo que
siempre se debe emplear la expresión "por cada" (tanto por
uno).
Información obtenida de una
ecuación química.
![]()
Información cualitativa: El calcio
sólido reacciona con el dioxígeno gaseoso y se
produce óxido de calcio sólido,
desprendiéndose energía en forma de
calor.
Información cuantitativa:
* N(x) Por cada 2 átomos de calcio
reacciona 1 molécula de dioxígeno y se
producen 2 entidades elementales de óxido de
calcio.
* n(x) Por cada 2 mol de calcio reacciona 1
mol de dioxígeno y se producen 2 mol de óxido de
calcio y se desprende energía en forma de
calor.
* m(x) por cada 80 g de calcio reaccionan
32 g de dioxígeno y se producen 112 g de óxido de
calcio y se desprende energía en forma de
calor.
Observación:

Clasificación de las reacciones
químicas.
En la clasificación se tienen en
cuenta dos criterios:
1- La energía calorífica
involucrada en la reacción
química.
2- La variación o no del
número de oxidación de los átomos de
los elementos
que forman las sustancias que intervienen
en la reacción química.
Según el criterio energético
las reacciones se clasifican en exotérmicas (liberan
energía en forma de calor) y endotérmicas
(absorben energía en forma de calor).
Ejemplos:

Atendiendo a la variación o no del
número de oxidación las reacciones se
clasifican en redox (si varia el número de
oxidación de los átomos de los elementos durante el
proceso) o no redox (si no varía el número de
oxidación).
2.4 Relaciones entre las masas de
sustancias que intervienen en una reacción
química.
Recordemos primeramente algunas magnitudes
que caracterizan a las muestras de sustancias puras y las
ecuaciones de definición que las relacionan:
Magnitudes: masa de sustancia m(x) Unidad
de medida: g —- gramos
cantidad de sustancia n(x) mol —-
mole
volumen de sustancia V(x) L —-
litros
Ecuaciones de
definición:

Existen dos leyes que se cumplen para todas
las reacciones químicas: la Ley de conservación
de la masa (ley de Lomonosov-Lavoisier).
La ley de conservación de la masa
expresa que:
"En una reacción
química la masa total de las sustancias reaccionantes
es igual a la masa total de las sustancias productos"
(La masa total es la suma de las masas de
cada una de las sustancias que participan en esa parte del
proceso).
En la ecuación de la reacción
química del calcio con el dioxígeno:

Unidad #3. El comportamiento termoquímico y
cinético de los procesos químicos
Autor:
Eraide Ballestero Creagh
 Página anterior Página anterior |   Volver al principio del trabajo Volver al principio del trabajo | Página siguiente  |