
2 La química nos enseña que existen en la
naturaleza básicamente, 92 “sustancias
simples” o “elementos” y un gran número
de “sustancias compuestas”. Siempre preocupó
la idea de cual sería la “naturaleza
íntima” de las sustancias. Precisamente fue el
filósofo griego Leucipo (-500; ?) y su discípulo
Demócrito (-460; -370), quienes por primera vez imaginaron
a todo lo existente, como compuesto por partículas
“muy pequeñas no divisibles”, que les llamaron
átomos. Etimológicamente la palabra
“átomo”, proviene del griego “a
tomos”, que significa “no divisible”.
Actualmente la división del átomo, es conseguida
con métodos físicos avanzados, pero al dividirlo,
desaparecen las propiedades químicas del elemento
original. No obstante, aunque su significado sea lo contrario, se
conserva el nombre primitivo. Modelos Atómicos

3 Modelo atómico: Un modelo atómico es una
representación estructural de un átomo, que trata
de explicar su comportamiento y propiedades. De ninguna manera
debe ser interpretado como el “dibujo” de un
átomo, sino más bien como el “diagrama
conceptual” de su funcionamiento. A lo largo del tiempo
existieron varios modelos atómicos, algunos más
elaborados que otros, debidos a Demócrito, Dalton,
Thomson, Perrin, Rutherford, Bohr, Sommerfeld, Schrödinger y
Dirac y Jordan. Finalmente trataremos de pesentar el modelo
actual conocido como: “Modelo Estandar”. Modelos
Atómicos

4 Podemos entonces definir actualmente al átomo como la
parte mas pequeña imaginable, de un elemento o sustancia
simple, que conserve las propiedades químicas del mismo.
Alrededor de 400 a.A.C. – Modelo atómico de
Demócrito. El primer modelo atómico, como ya se
mencionó, fue postulado por el filósofo y
matemático griego Demócrito. No tenía
ninguna imagen concreta, sino que solo era una idea conceptual:
“lo que es” (átomos) y “lo que no
es” (vacío). Entre las afirmaciones básicas
decía que: “Los átomos son eternos,
indivisibles, homogéneos, incompresibles e invisibles; los
átomos se diferencian solo en forma y tamaño, pero
no por cualidades internas; las propiedades de la materia
varían según el agrupamiento de los
átomos”. Se oponía a la idea muy antigua,
pero generalizada por el filósofo Sócrates (-469;
-399), de los cuatro elementos básicos: “tierra,
agua, aire y fuego”, ideas que perduraron a través
de la Edad Media y hasta el Renacimiento. Modelos
Atómicos

5 1808 – Modelo atómico de John Dalton. Nunca en la
historia se esbozó siquiera una idea respecto de la
supuesta conformación o naturaleza del átomo (ni
aún los alquimistas de la edad media). Recién hacia
el año 1808 el químico inglés John Dalton
(1766-1844), postuló el primer modelo atómico con
bases científicas, ya que surgió apoyándose
en experimentaciones químicas bien fundamentadas: Toda la
materia se podía dividir en dos grandes grupos: los
elementos y los compuestos. Los elementos estarían
constituidos por unidades fundamentales, que en honor a
Demócrito, Dalton denominó átomos. Los
compuestos se conformarían por moléculas, cuya
estructura viene dada por la unión de átomos en
proporciones definidas y constantes. De esto surgió la
idea del “Peso atómico químico”. La
teoría de Dalton seguía considerando el hecho de
que los átomos eran partículas indivisibles. Pero
nada se dijo sobre su naturaleza íntima o su estructura.
Modelos Atómicos

6 En 1808 Gay-Lussac (frances;1778-1850), en 1811 Avogadro
(italiano; 1776-1856) y en 1833 Faraday (inglés;
1791-1867), contribuyeron con diferentes experiencias y
teorías a afianzar la idea del átomo macizo de
Dalton, que permaneció vigente prácticamente
durante todo el siglo XIX. 1897 – Modelo Atómico de
Thomson (o modelo del budín con pasas).. El descubrimiento
de los “rayos catódicos” por Hittorf
(alemán;1824-1914) en 1869 y las experiencias de Lenard
(austro-húngaro; 1862-1947), imaginando al
“electrón”, llevaron a J.J.Thomson
(inglés;1856-1940) en 1897, a “descubrir realmente
al electrón” , con su carga eléctrica
negativa. Esto último lo llevó suponer que el
átomo era una “masa positivamente cargada y
difusa” en la cual estarían “embebidos”
los electrones. Modelos Atómicos

7 El modelo atómico de Thomson era concebido como una
esfera maciza con carga eléctrica positiva dentro de la
cual estaban incluidos los electrones negativos. A principios del
Siglo XX este modelo atómico era aceptado normalmente.
Modelo Atómico de Perrin: Poco tiempo después que
Thomson, Jean Baptiste Perrin (frances 1870 – 1942) que
también había investigado los rayos
catódicos, introdujo una modificación de la
estructura anterior, afirmando que los electrones, como cargas
negativas, estaban en la parte exterior de la esfera positiva. No
fue ésta una contribución fundamental al modelo
atómico anterior, pero estableció una cierta
“libertad” para los electrones. Modelos
Atómicos

8 1911 – Modelo atómico de Rutherford. Cuidadosas
experimentaciones llevaron a Ernest Rutherford
(neozelandés- británico; 1871 – 1937) al
convencimiento de que el átomo no era macizo sino que era
un “inmenso espacio vacío”. En efecto, de
acuerdo con este modelo y refiriéndonos al
Hidrógeno, (el elemento mas liviano), el átomo
estaba formado por un “núcleo central” fijo,
con la mayor parte de la masa del átomo y carga
eléctrica positiva, llamado “protón”;
rodeado por un “electrón” de escasa masa y
carga eléctrica negativa, describiendo una órbita
circular a gran distancia del núcleo. El equilibrio
orbital se debía a la fuerza centrífuga,
oponiéndose a la atracción electrostática
entre las partículas. Este “pequeño sistema
solar en miniatura” es la imagen visual que todos tenemos
del átomo moderno. En las figuras que siguen van a quedar
mas claras la descripciones anteriores. Modelos
Atómicos

m 9 Atomo de Hidrógeno – Modelo de Rutherford – 1911
Electrón (-) Diámetro orbital: 10-10 m
Diámetro del núcleo: 10 -15 + Protón (+)
Masa del protón: 1,673 . 10-27 kg Masa del
electrón: 1/1836 Mp (alrededor de 2000 veces mas
pequeño) Modelos Atómicos

+ Atomo de Hidrógeno – Modelo de Rutherford – 1911
Comparación de sus medidas Cabeza de alfiler 500 m Bolita
de juegos infantiles Esta imagen justifica la afirmación
sobre el átomo, de que es “un inmenso espacio
vacío”. Modelos Atómicos 10

• • Átomo de Hidrógeno (H) Un
electrón en órbita. Un protón en el
núcleo. 1p (+) Modelos Atómicos 11

• • Átomo de Helio (He) dos electrones en
órbita dos protones, mas dos neutrones en el núcleo
2 p (+) 2n Se debe señalar que el neutrón ,
partícula eléctricamente neutra, pero de masa igual
a la del protón, fue concebido como idea teórica,
necesaria para justificar el peso atómico químico.
Recién se descubrió materialmente en 1932 . Modelos
Atómicos 12

• • Átomo de Litio (Li) tres electrones en
órbitas. tres protones, mas cuatro neutrones en el
núcleo. 3 p (+) 4n Modelos Atómicos 13

En general, de aquí en adelante, los átomos de los
elementos siguientes van teniendo mas electrones en
órbitas, aumentando de a una unidad, hasta llegar al
elemento natural mas pesado, el URANIO , que tiene 92 electrones
orbitales. Tiene también 92 protones en el núcleo y
un número de neutrones que puede variar entre 142 y 146.
El número de electrones orbitales, eléctricamente
negativos, igual a la cantidad de protones en el núcleo,
eléctricamente positivos, caracteriza a un elemento
químico y se conoce como: « Número
Atómico (Z) » . Asimismo, el número de
partículas totales en el núcleo, protones mas
neutrones, se denomina: « Peso Atómico (A) » .
Modelos Atómicos 14

12 14 U U Átomos del mismo elemento químico, (es
decir con igual número atómico), pueden tener
núcleos con diferente cantidad de neutrones (distintos
pesos atómicos). Estos átomos de igual
«Z» pero de diferente «A», se conocen
como: « Isótopos » Internacionalmente, se
anota un elemento con su símbolo químico, colocando
a su izquierda el A como índice y el Z como
subíndice. 12 C 12 C 238 92 235 92 Pero para facilitar la
escritura suele ponerse el valor del Peso Atómico,
directamente a continuación del símbolo. Ejemplos:
C 12, O 16, Fe 56, Cu 63, Ag 107, Ag 109, (isótopos de la
Plata) U 234, U 235, U 238, (isótopos del Uranio) Modelos
Atómicos 15

El átomo de Rutherford nada decía sobre las
órbitas de los electrones (salvo que eran circulares).
Además contradecía las leyes de Maxwell del
electromagnetismo. En efecto los electrones que son
partículas eléctricamente cargadas y en movimiento
circular (es decir acelerado), deberían, de acuerdo con
aquella teoría, emitir continuamente energía en
forma de fotones. Por ello los electrones perderían
energía y caerían sobre el núcleo del
átomo. El modelo de Rutherford era así
“inestable”, contrariando la aparente estabilidad de
la materia que nos rodea. Por otra parte, no brindaba ninguna
explicación sobre fenómenos físicos
conocidos, tales como la emisión de espectros
ultravioletas, luminosos, infrarrojos o de rayos X,
característicos de cada elemento. Modelos Atómicos
16

1913 – Modelo atómico de Bohr Basándose
conceptualmente en el modelo de Rutherfod , el danés Niels
Bohr (1895 – 1962), enunció un nuevo modelo tal que,
admitiendo la “estructura planetaria” anterior,
permitiera explicar las contradicciones antes señaladas.
Para eso se fundamentó en la incipiente
“mecánica cuántica” de Max Plank
– (alemán –1858-1947) y las investigaciones
sobre “fotoelectricidad” de Albert Einstein –
(alemán nacionalizado estadounidense-1879-1955). Su
teoría tiene un fuerte apoyo matemático, pero
básicamente se afirma en tres postulados: 1. Mientras
permanecen en una órbita, los electrones no emiten
energía. (enunciado en contradicción con el
electromagnetismo clásico). 2. No todas las órbitas
son permitidas, sino aquellas que fija una expresión
matemática en función de un número entero
“n” (n=1; 2; 3; 4; 5; 6 y 7) llamado
“número cuántico radial o principal
“(cuantificación). 3. Cada órbita define un
nivel de energía y solo hay emisión o
absorción de ella, cuando un electrón salta de una
órbita a otra. (explicación de espectros). Modelos
Atómicos 17
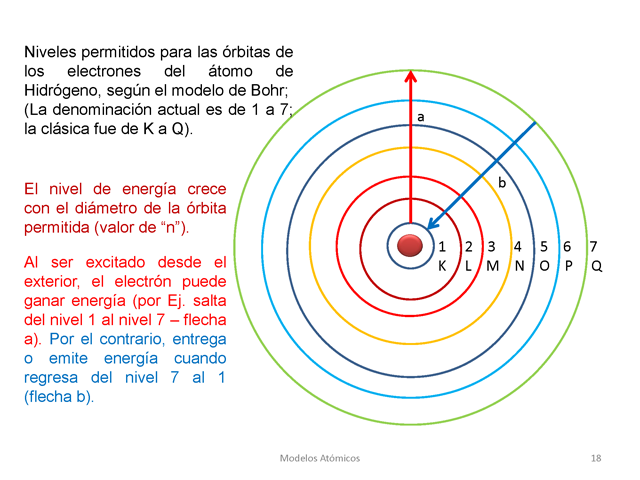
a b 1 K 7 Q Niveles permitidos para las órbitas de los
electrones del átomo de Hidrógeno, según el
modelo de Bohr; (La denominación actual es de 1 a 7; la
clásica fue de K a Q). El nivel de energía crece
con el diámetro de la órbita permitida (valor de
“n”). Al ser excitado desde el exterior, el
electrón puede ganar energía (por Ej. salta del
nivel 1 al nivel 7 – flecha a). Por el contrario, entrega o
emite energía cuando regresa del nivel 7 al 1 (flecha b).
Modelos Atómicos 2 3 4 5 6 L M N O P 18

Las explicaciones teóricas del modelo de Bohr coincidieron
con la experimentación para el átomo de
Hidrógeno, en relación con los espectros de
emisión electromagnética de:
“ultravioleta” (serie de Lyman); (órbitas 2;
3; 4; 5 y 6 contra nivel 1). “luz visible” (serie de
Balmer); (órbitas 3; 4; 5 y 6 saltando a la 2).
“infrarrojo cercano” (serie de Paschen);
“infrarrojo remoto” (serie de Brackeett); (niveles 4;
5 y 6 con el 3). (niveles 5; 6 y 7 contra la órbita 4).
También permitieron justificar la realidad en el caso del
Helio, pero aparecían algunas discrepancias al intentar
explicar los espectros de emisión de elementos mas
complejos. En efecto, en todos los casos aparecían
“niveles de energía” que diferían de
los previstos. Era como si para una misma órbita
existiesen “varios subniveles”. Resultaba evidente
que el número “n” era insuficiente para
describir todos los estados posibles de un electrón en los
átomos de los elementos mas complicados que el
Hidrógeno o el Helio. Modelos Atómicos 19

1916 – Modelo atómico de Sommerfeld Teniendo en cuenta los
anteriores modelos de Rutherford–Bohr, el físico
alemán Arnold Sommerfeld (1868 – 1951)
enunció en 1916 una nueva versión del modelo
atómico, introduciendo una visión
“relativista”. Generalizó la teoría
agregando al “número cuántico principal o
radial”de Bohr “n”, un segundo
“número cuántico azimutal”,
“l”. Esto originó que del anterior concepto de
órbitas circulares se pasara a la idea de órbitas
“elípticas”, que fue finalmente la
única idea válida agregada. La modificación
de las órbitas se cumple solo a partir del nivel
“n=2” Modelos Atómicos 20

1926 – Modelo atómico de Schrödinger Basándose
en la teoría elaborada en 1924, por el físico
francés, Louis-Victor de Broglie (1892-1987) sobre la
dualidad “onda–corpúsculo” y en la
“mecánica cuántica” de Max Planck
(alemán 1858-1947), en 1926 el físico
austríaco Erwin Rudolf Josef Alexander Schrödinger
(1887-1961), desarrolló la “mecánica
ondulatoria”. En efecto, para de Broglie toda
partícula material podía ser considerada como una
onda; en forma similar al comportamiento dual de la luz: como
onda electromagnética o como “fotón”
(postulado en 1905 por Einstein, por aplicación de las
ideas de Planck). El principio de “de Broglie” de la
“dualidad” es fundamental en la
“mecánica cuántica”. Schrödinger
consideró a los electrones como “ondas”,
aplicó las matemáticas de Hamilton (irlandés
1805-1865) y desarrolló una ecuación de “gran
complejidad matemática”. No obstante sólo
pudo resolver con exactitud el átomo de hidrógeno y
con cierta incertidumbre el átomo de helio. Para resolver
átomos distintos se recurrió posteriormente a
métodos de resolución aproximados. Modelos
Atómicos 21

En el modelo de Schrödinger se abandona la imagen de los
electrones como pequeñas esferitas cargadas
eléctricamente que giran alrededor del núcleo en
órbitas geométricas. En lugar de esto se describe a
los electrones como una “función de onda”, el
cuadrado de la cual representa la “probabilidad” de
encontrar a la partícula en una zona del espacio
(alrededor del núcleo). Las “nubes de
probabilidad” que remplazan a la idea de las órbitas
geométricas circulares o elípticas anteriores, se
conocen como “orbitales” y sus formas, en apariencia
caprichosas, son también consecuencia de las soluciones
matemáticas teóricas de la ecuación de
Schrödinger. Modelos Atómicos 22

Modelos Atómicos 23

Con su ecuación matemática, Schrödinger
trató de describir las características de todos los
electrones de un átomo, en cuanto a las energías,
formas y orientaciones de los orbitales. Para ello introdujo lo
que se conoce como “números cuánticos”,
que caracterizan las soluciones de la ecuación propuesta.
Los números cuánticos son tres: n = número
cuántico principal, que indica el “nivel de
energía” donde se encuentra el electrón;
asume valores enteros positivos del 1 al 7 . l = número
cuántico secundario, que indica el “subnivel de
energía” del orbital en el que se encuentra el
electrón , puede ser s , p , d y f (0 , 1 , 2 y 3 ). m =
número cuántico magnético , representa la
orientación de los orbitales en el espacio. Modelos
Atómicos 24

1930 – Modelo Atómico de Dirac y Jordan. A partir de
1928 Paul A.M. Dirac (inglés, 1902-1984) y Pascual
Jordán (alemán, 1902-1980), basándose en la
mecánica cuántica ondulatoria, introdujeron una
descripción cuántico-relativista del
electrón, postulando la existencia de la antimateria. En
las ecuaciones aparece el cuarto número cuántico,
denominado “s”, además de los ya conocidos
"n“, "l" y "m“ (que planteaba Schrödinger). De
acuerdo con las transformaciones iniciada por Born y Jordan y
desarrollada en toda su amplitud por Jordán y Dirac, se
llegó a la conclusión de que la estructura formal
de la mecánica cuántica se había integrado.
Esto dio lugar a que en los años siguientes se formalizara
la actual “teoría de la electrodinámica
cuántica”. En 1930, con el cuarto número
cuántico, se agregó la forma de los orbitales del
subnivel superior y la estructura electrónica de los
átomos quedó conformada en forma definitiva. Se
había perfeccionado la solución cuántica
anterior. Modelos Atómicos

8 Para mayor facilidad en la construcción del
“edificio electrónico”, se presenta una tabla
que permite conocer la configuración y la
localización exacta de los electrones en cuanto a
“niveles y subniveles de energía”: 1s2 / 2s 2
2p 6 / 3s 2 3p 6 / 4s23d104p6 / 5s24d105p6 / 6s24f145d106p6 / 7s
2 5f 14 6d 107p6 1 2 3 4 5 6 7 Los siete “niveles” se
enfrentan con las “subcáscaras” s, p, d y f.
Como índice, se indica en cada caso, el número
máximo de electrones que puede contener cada una. Se puede
comprobar que cada “nivel energético
principal” acepta un número máximo de
electrones: Nivel 1 (capa K) 2 Nivel 2 (capa L) Nivel 3 (capa M)
8 Nivel 4 (capa N) 18 Nivel 5 (capa O) 18 Nivel 6 (capa P) 32
Nivel 7 (capa Q) 32 Modelos Atómicos 26

La estructura electrónica de los elementos
químicos, agrupados por niveles de energía
crecientes de abajo hacia arriba, se muestra en el
gráfico: Se separan en siete períodos, de acuerdo
con la “Tabla Periódica”. En el extremo
derecho se indican las siete “capas” o
“cáscaras” cuánticas principales (K; L;
M; N; O; P; y Q), mientras que a la izquierda se señalan
las “subcáscaras” secundarias (s; p; d y f).
Modelos Atómicos 27

1 Átomo de Hidrógeno (H) 1 electrón 1º
capa ó nivel : 1p (+) 1s1 Modelos Atómicos 28

2 Átomo de Helio (He) 2 electrones 1º capa ó
nivel: 2 p (+) 2n 1s2 Modelos Atómicos 29

2 1 Átomo de Litio (Li) 3 electrones 1º capa ó
nivel: 2º capa ó nivel: 3 p (+) 4n 1s2; 2s1 Modelos
Atómicos 30

2 2 Átomo de Berilio (Be) 4 electrones 1º capa
ó nivel: 2º capa ó nivel: 4 p (+) 5n 1s2; 2s2
Modelos Atómicos 31

2 3 Átomo de Boro (B) 5 electrones 1º capa ó
nivel: 2º capa ó nivel: 5 p (+) 6n 1s2; 2s2; 2p1
Modelos Atómicos 32

2 4 Átomo de Carbono (C) 6 electrones 1º capa
ó nivel: 2º capa ó nivel: 6 p (+) 6n 1s2; 2s2;
2p2 Modelos Atómicos 33

2 5 Átomo de Nitrógeno (N) 7 electrones 1º
capa ó nivel: 2º capa ó nivel: 7p (+) 7n 1s2;
2s2; 2p3 Modelos Atómicos 34

2 6 Átomo de Oxígeno 8 electrones 1º capa
ó nivel: 2º capa ó nivel: 8 p (+) 7n 1s2; 2s2;
2p4 Modelos Atómicos 35

2 7 Átomo de Fluor 9 electrones (-) 1º capa ó
nivel: 2º capa ó nivel: 9 p (+) 10 n 1s2; 2s2; 2p5
Modelos Atómicos 36

2 8 Átomo de Neón (Ne) 10 electrones (-) 1º
capa ó nivel: 2º capa ó nivel: 10 p (+) 11 n
1s2; 2s2; 2p6 Modelos Atómicos 37

2 8 1 Átomo de Sodio (Na) 11 electrones 1º capa
ó nivel: 2º capa ó nivel: 3º capa
ó nivel: 11 p (+) 12 n 1s2; 2s2; 2p6; 3s1 Modelos
Atómicos 38

2 8 4 Átomo de Silicio 14 electrones 1º capa ó
nivel: 2º capa ó nivel: 3º capa ó nivel:
1s2, 2s2, 2p6, 3s2, 3p2 Modelos Atómicos 14p (+) 14n El
núcleo y la 1º y 2º capa, forman el “Casco
Atómico” 39

Atomo de Uranio, mostrando los 92 electrones ubicados en 7
niveles o capas. Cada nivel tiene marcados los subniveles.
Modelos Atómicos 40
